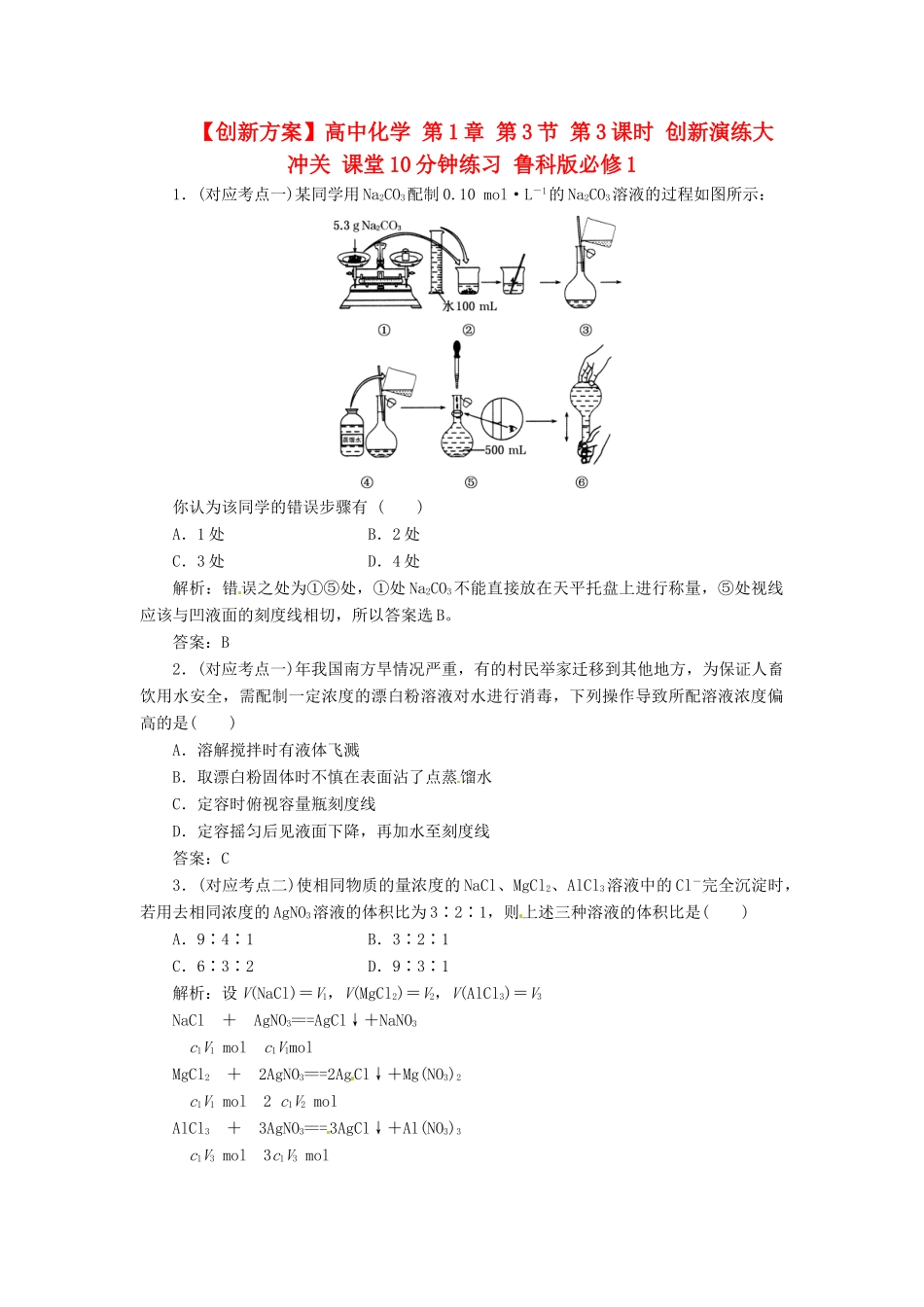
【创新方案】高中化学第1章第3节第3课时创新演练大冲关课堂10分钟练习鲁科版必修11.(对应考点一)某同学用Na2CO3配制0.10mol·L-1的Na2CO3溶液的过程如图所示:你认为该同学的错误步骤有()A.1处B.2处C.3处D.4处解析:错误之处为①⑤处,①处Na2CO3不能直接放在天平托盘上进行称量,⑤处视线应该与凹液面的刻度线相切,所以答案选B。答案:B2.(对应考点一)年我国南方旱情况严重,有的村民举家迁移到其他地方,为保证人畜饮用水安全,需配制一定浓度的漂白粉溶液对水进行消毒,下列操作导致所配溶液浓度偏高的是()A.溶解搅拌时有液体飞溅B.取漂白粉固体时不慎在表面沾了点蒸馏水C.定容时俯视容量瓶刻度线D.定容摇匀后见液面下降,再加水至刻度线答案:C3.(对应考点二)使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-完全沉淀时,若用去相同浓度的AgNO3溶液的体积比为3∶2∶1,则上述三种溶液的体积比是()A.9∶4∶1B.3∶2∶1C.6∶3∶2D.9∶3∶1解析:设V(NaCl)=V1,V(MgCl2)=V2,V(AlCl3)=V3NaCl+AgNO3===AgCl↓+NaNO3c1V1molc1V1molMgCl2+2AgNO3===2AgCl↓+Mg(NO3)2c1V1mol2c1V2molAlCl3+3AgNO3===3AgCl↓+Al(NO3)3c1V3mol3c1V3mol由题意可知,c1V1∶2c1V2∶3c1V3=3∶2∶1,故V1∶V2∶V3=9∶3∶1。答案:D4.(对应考点二)11.2gFe与500mL2mol·L-1的盐酸反应,生成标准状况下H2的体积为()A.11.2LB.2.24LC.4.48LD.3.36L解析:设Fe完全反应需HCl的物质的量为n,n(Fe)=0.2mol,则Fe+2HCl===FeCl2+H2↑1mol2mol0.2moln1∶2=0.2mol∶n,n=0.4mol<1mol即盐酸过量,用Fe求H2的物质的量,Fe+2HCl===FeCl2+H2↑1mol22.4L0.2molV(H2)得,V(H2)=4.48L。答案:C5.(实验题)取100mLNa2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀,再用过量稀硝酸处理沉淀,沉淀的质量减少到4.66g,并有气体放出。计算(要写出计算步骤):(1)原混合溶液Na2SO4的物质的量浓度为_________________________________。(2)①用固体Na2SO4配制250mL以上浓度的溶液时,所用到的仪器有________________________________________________________________________。②定容时若仰视刻度线,会使所配溶液的浓度________(“偏高”、“偏低”或“无影响”)。③定容时,不小心液面超过刻度线,再用胶头滴管吸出溶液至凹液面与刻度线相平,会使所配溶液的浓度________(“偏高”、“偏低”或“无影响”)。(3)产生的气体在标准状况下的体积为_________________________________________。解析:(1)由题意可知:m(BaCO3)+m(BaSO4)=14.51g。其中m(BaSO4)=4.66g,即n(BaSO4)==0.02mol,n(BaCO3)==0.05mol。故n(SO)=0.02mol,n(CO)=0.05mol,则n(Na2SO4)=0.02mol,n(Na2CO3)=0.05mol,c(Na2SO4)==0.2mol·L-1。(2)②仰视刻度线,使溶液体积偏大,则造成浓度偏低。③吸收一部分溶液,使溶质减小,造成浓度偏低。(3)Na2CO3+Ba(OH)2===BaCO3↓+2NaOH,BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑,即生成气体的关系式为Na2CO3~CO2↑,故n(CO2)=n(Na2CO3)=0.05mol。标准状况下气体V=0.05mol×22.4L·mol-1=1.12L。答案:(1)0.2mol·L-1[(2)①托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管②偏低③偏低(3)1.12L