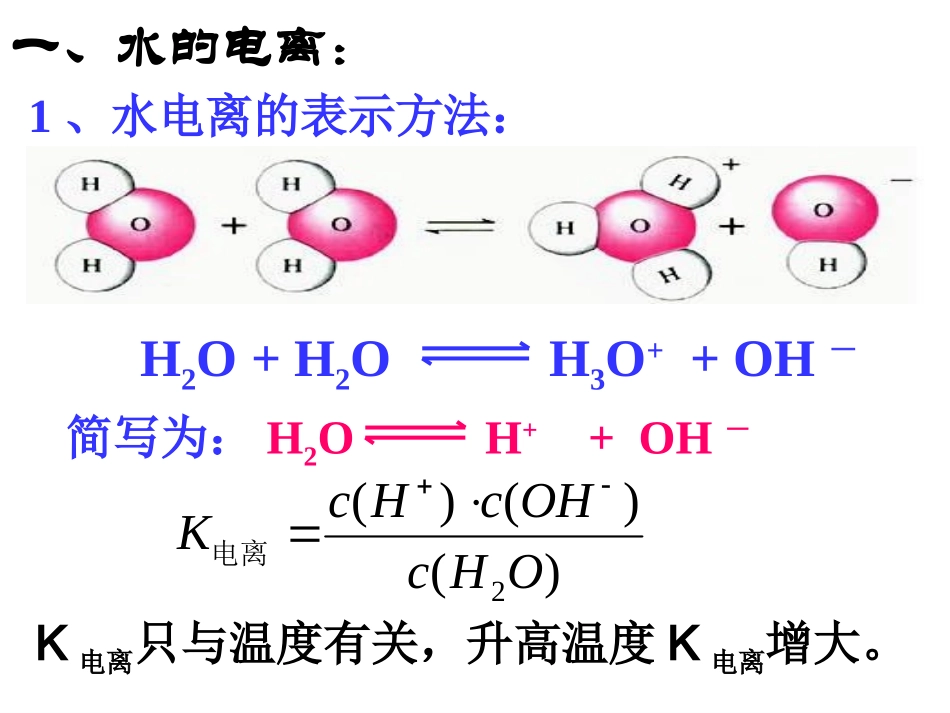
本节学习目标:1、知道水是一种极弱的电解质,在一定温度下,水的离子积是常数2、初步掌握测定溶液pH的方法,能进行pH的简单计算,知道溶液pH的调控在工农业生产和科学研究中的重要作用。H2O+H2OH3O++OH-简写为:H2OH++OH-1、水电离的表示方法:一、水的电离:)()()(2OHcOHcHcK电离K电离只与温度有关,升高温度K电离增大。2、水电离的特征:(2)水的电离程度很小;(1)c(H+)水=c(OH-)水(3)25℃纯水中,c(H+)=c(OH-)=1×10-7mol/L室温时,1L水(55.6molH2O)中只有1×10-7mol电离常温,KW=c(H+)·c(OH-)=1×10-14(4)25℃时,K电离×c(H2O)=Kw(水的离子积常数,简称水的离子积)(5)KW不仅适用于纯水,也适用于稀的电解质溶液。移动方向c(H+)c(OH-)KWHCl(g)NaOH(s)NaCl(s)CH3COONa(s)NH4Cl(s)升高温度影响水的电离平衡的因素加入物质变化H2OH++OH-增大减小分子化方向不变分子化方向减小增大不变不移动不变不变不变离子化方向减小增大不变离子化方向增大减小不变离子化方向增大增大增大3、影响水的电离平衡的因素:1、温度:升高温度,平衡向水的电离方向移动,电离程度增大。c(H+)和c(OH-)均增大,KW也增大c(H+)=c(OH-)>1×10-7mol/L(T>25℃纯水)2、浓度:KW=c(H+)·c(OH-)>1×10-14(T>25℃纯水或稀溶液)增大c(H+)或c(OH-),平衡向结合成水方向移动;减小c(H+)或c(OH-),平衡向水的电离的方向移动。1、判断正误:任何水溶液中都存在水的电离平衡。任何水溶液中,都存在Kw=10-14。某温度下,某液体c(H+)=10-7mol/L,则该溶液一定是纯水。2、水的电离为:H2OH++OH-,已知KW35℃=2.1×10-14。则下列叙述正确的是:A、c(H+)升高时,c(OH-)一定降低B、在35℃时,纯水中c(H+)>c(OH-)C、条件改变,c(H+).c(OH-)之积不变D、水的电离是一个吸热过程D3、能影响水的电离平衡,并使溶液中的且c(H+)>c(OH-)的操作是A.向水中投入一小块金属钠B.将水加热煮沸C.向水中通入二氧化碳气体D.向水中加入食盐晶体CKW的应用——计算溶液中的c(H+)或c(OH—)1、常温下,0.01mol/L盐酸溶液中,c(H+)、c(OH-)分别为多少?2、常温下,0.01mol/LNaOH溶液中,c(H+)、c(OH-)分别为多少?c(H+)=0.01mol/Lc(OH-)=10-12mol/Lc(OH-)=0.01mol/Lc(H+)=10-12mol/L3、常温下,20mL0.1mol/L的盐酸,与30mL0.05mol/LBa(OH)2溶液混合,求混合液中c(H+)、c(OH-)。Ba(OH)2过量c(OH-)=0.02mol/Lc(H+)=5×10-13mol/LKW的应用——计算溶液中的c(H+)或c(OH—)4、25℃:A、B、C三种溶液,其中:A中c(H+)=10-3mol/LB中c(OH-)=510-7mol/LC中c(H+)/c(OH-)=106,则三种溶液的c(H+)由大到小顺序。KW的应用——计算溶液中的c(H+)或c(OH—)B中c(H+)=210-8mol/LC中c(H+)=10-4mol/LA>C>B例1、常温下,0.01mol/L盐酸溶液中。c(OH-)是多少?由水电离出的c(H+)H2O是多少?KW的应用——计算c(H+)H2O或c(OH-)H2O例2、0.01mol/LNaOH溶液中。c(H+)是多少?由水电离出的c(H+)H2O和c(OH-)H2O分别是多少?c(OH-)=c(H+)H2O=10-12mol/L注意:任何水溶液中由水电离出来的c(H+)H2O=c(OH-)H2Oc(H+)=c(H+)H2O=c(OH-)H2O=10-12mol/L5、25℃、浓度均为0.1mol/L的下列溶液中c(H+)由大到小的排列顺序:①氨水②NaOH③盐酸④醋酸KW的应用——计算溶液中的c(H+)或c(OH—)③④①②2、常温下,0.05mol/L的硫酸溶液中由水电离产生的c(H+)是多少?在100℃时呢?1、0.1mol/LNaOH溶液中的OH-的浓度为?水电离出的OH-浓度为?KW的应用——计算c(H+)H2O或c(OH-)H2O3、浓度均为0.1mol/L的下列溶液中由水电离出的c(H+)H2O大小关系为:①盐酸②醋酸溶液③硫酸溶液④氢氧化钠溶液c(OH-)=0.1mol/Lc(OH-)H2O=10-13mol/Lc(H+)H2O25℃=10-13mol/Lc(H+)H2O100℃=10-11mol/L②>=>①④③KW的应用——计算c(H+)H2O或c(OH-)H2O4、在某温度下纯水中c(H+)=3.0×10-7mol/L,此时纯水中c(OH-)为:。5、25℃时,在0.1mol·L-1的盐酸溶液中:c(H+)=,c(OH-)=。由水电离出的c(H+)=。6、在0.01mol·L-1的硫酸溶液中由水电离出的c(H+)=。3.0×10-7mol/L0.1mol/L1×10-13mol/L1×10-13mol/L5×10-13mol/L【例】25℃时,某物质水溶液中由...