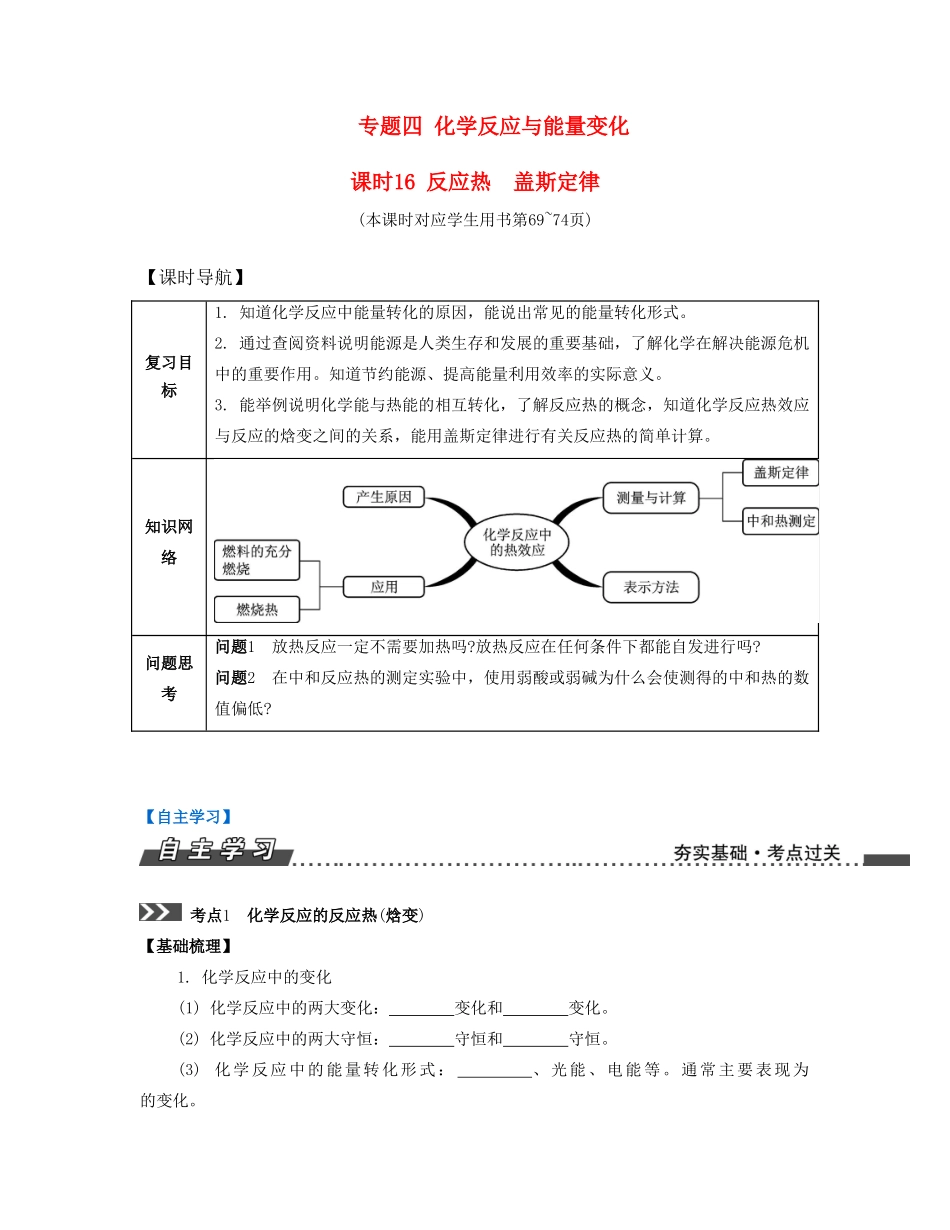
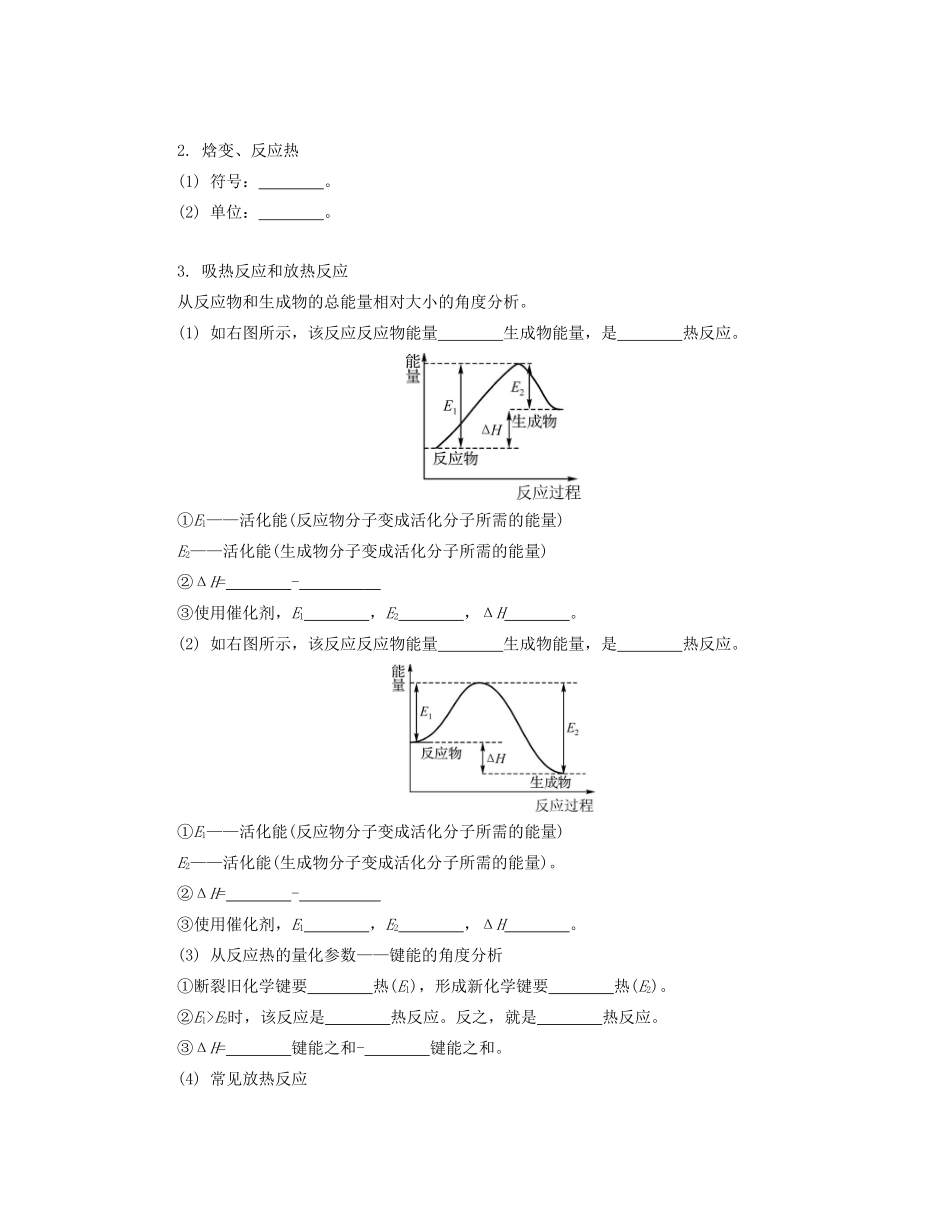
专题四化学反应与能量变化课时16反应热盖斯定律(本课时对应学生用书第69~74页)【课时导航】复习目标1.知道化学反应中能量转化的原因,能说出常见的能量转化形式。2.通过查阅资料说明能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。知道节约能源、提高能量利用效率的实际意义。3.能举例说明化学能与热能的相互转化,了解反应热的概念,知道化学反应热效应与反应的焓变之间的关系,能用盖斯定律进行有关反应热的简单计算。知识网络问题思考问题1放热反应一定不需要加热吗?放热反应在任何条件下都能自发进行吗?问题2在中和反应热的测定实验中,使用弱酸或弱碱为什么会使测得的中和热的数值偏低?【自主学习】考点1化学反应的反应热(焓变)【基础梳理】1.化学反应中的变化(1)化学反应中的两大变化:变化和变化。(2)化学反应中的两大守恒:守恒和守恒。(3)化学反应中的能量转化形式:、光能、电能等。通常主要表现为的变化。2.焓变、反应热(1)符号:。(2)单位:。3.吸热反应和放热反应从反应物和生成物的总能量相对大小的角度分析。(1)如右图所示,该反应反应物能量生成物能量,是热反应。①E1——活化能(反应物分子变成活化分子所需的能量)E2——活化能(生成物分子变成活化分子所需的能量)②ΔH=-③使用催化剂,E1,E2,ΔH。(2)如右图所示,该反应反应物能量生成物能量,是热反应。①E1——活化能(反应物分子变成活化分子所需的能量)E2——活化能(生成物分子变成活化分子所需的能量)。②ΔH=-③使用催化剂,E1,E2,ΔH。(3)从反应热的量化参数——键能的角度分析①断裂旧化学键要热(E1),形成新化学键要热(E2)。②E1>E2时,该反应是热反应。反之,就是热反应。③ΔH=键能之和-键能之和。(4)常见放热反应①可燃物的燃烧;②酸碱中和反应;③铝热反应;④金属跟酸的置换反应;⑤物质的缓慢氧化;⑥大多数化合反应。(5)常见吸热反应①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气的反应;⑤C和CO2的反应。【举题说法】类型一反应进程与能量变化例题1(2015·扬州一模)某温度时,N2与H2反应过程中的能量变化如下图所示。下列叙述正确的是()A.1molN2与3molH2充分反应可以放出92kJ的热量B.b曲线是加入催化剂时的能量变化曲线C.加入催化剂,该反应的焓变减小D.正反应的活化能等于逆反应的活化能【答案】B【解析】N2与H2的反应是可逆反应,不能完全反应生成NH3,故放出的热量小于92kJ,A错误;由图可看出,b中反应的活化能小,故b加入了催化剂,B正确;加入催化剂不能改变反应的焓变,C错误;由图可看出,正反应的活化能为508kJ·mol-1,逆反应的活化能为600kJ·mol-1,D错误。变式1(2015·苏锡常二模)下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是()A.由MgCl2制取Mg是放热过程B.热稳定性:MgI2>MgBr2>MgCl2>MgF2C.常温下氧化性:F2Cl>Br>I,故氧化性:F2>Cl2>Br2>I2,C错误;因为MgBr2(s)Mg(s)+Br2(g)ΔH=+524kJ·mol-1、MgCl2(s)Mg(s)+Cl2(g)ΔH=+641kJ·mol-1,将第一个热化学方程式减去第二个热化学方程式可得D项热化学方程式,正确。类型二反应热与键能关系例题2(2015·浙江高考)乙苯催化脱氢制苯乙烯反应:(1)已知:化学键C—HC—CCCH—H键能/kJ·mol-1412348612436计算上述反应的ΔH=kJ·mol-1。【答案】+124【解析】反应热=反应物总键能-生成物总键能,由有机物的结构可知,应是—CH2CH3中总键能与—CHCH2、H2总键能之差,故ΔH=(5×412+348-3×412-612-436)kJ·mol-1=+124kJ·mol-1。变式2(2014·重庆高考)已知C(s)+H2O(g)CO(g)+H2(g)ΔH=akJ·mol-1,2C(s)+O2(g)2CO(g)ΔH=-220kJ·mol-1,H—H、OO和O—H键的键能分别为436、496和462kJ·mol-1,则a为()A.-332B.-118C.+350D.+130【答案】D【解析】将已知的两个反应编号为①②,②-①×2即可...