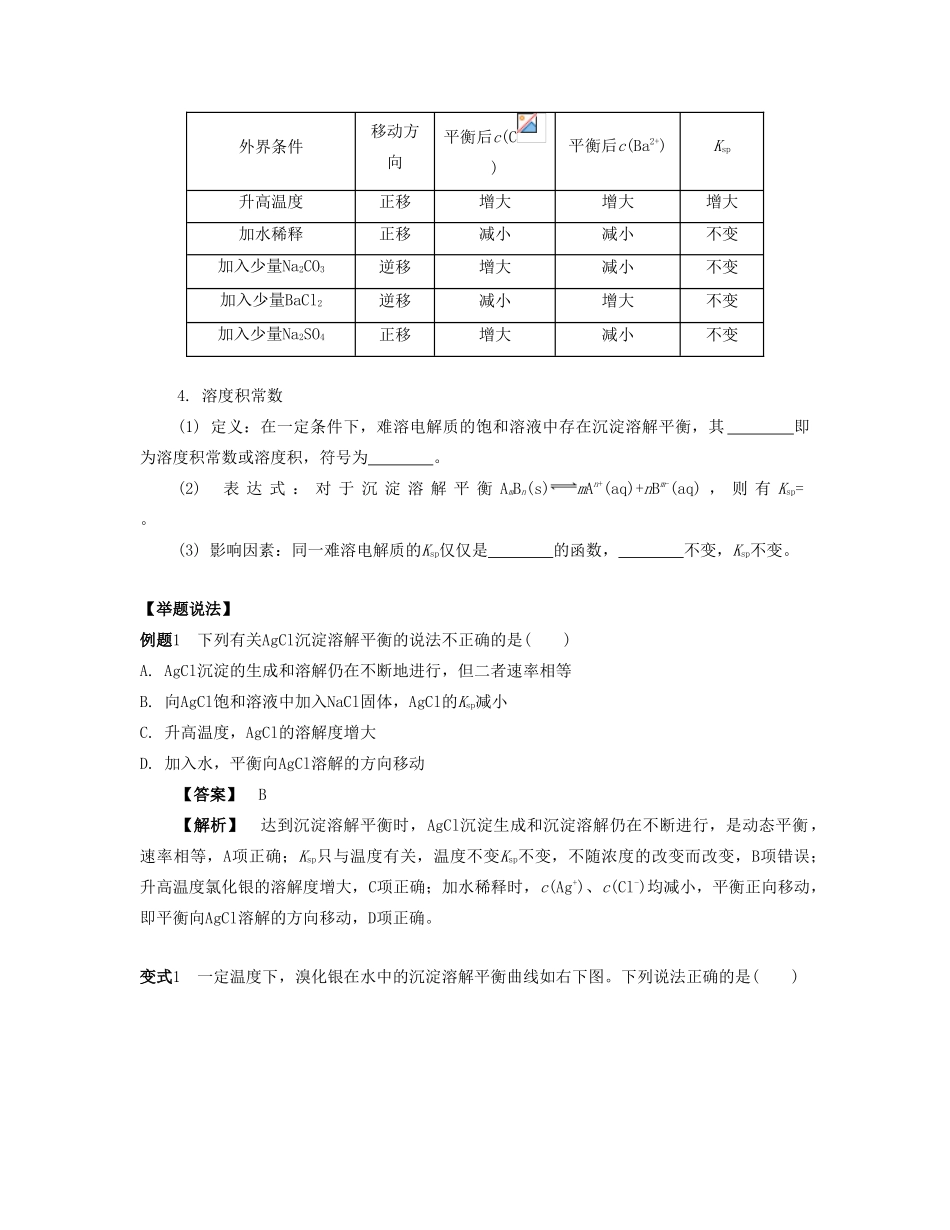
课时27难溶电解质的溶解平衡(本课时对应学生用书第116~118页)【课时导航】复习目标1.理解难溶电解质存在沉淀溶解平衡。2.能运用溶度积常数进行简单计算。知识网络问题思考问题1溶度积常数Ksp与哪些因素有关?问题2沉淀转化时,溶解度小的可以转化为溶解度大的吗?【自主学习】考点1沉淀溶解平衡【基础梳理】1.概念:在一定温度下,当难溶电解质在水中形成溶液时,速率与速率相等,达到平衡状态。2.溶解平衡的特征动—动态平衡,v(溶解)0,v(沉淀)0等—v(溶解)v(沉淀)定—达到平衡时,溶液中离子的浓度变—当改变外界条件时,溶解平衡将发生移动,达到新的平衡3.沉淀溶解平衡的影响因素(1)内因:难溶电解质本身的性质。绝对不溶的物质是没有的,同样是微溶物质,溶解度差别也很大。(2)外因[以BaCO3(s)C(aq)+Ba2+(aq)ΔH>0为例]外界条件移动方向平衡后c(C)平衡后c(Ba2+)Ksp升高温度正移增大增大增大加水稀释正移减小减小不变加入少量Na2CO3逆移增大减小不变加入少量BaCl2逆移减小增大不变加入少量Na2SO4正移增大减小不变4.溶度积常数(1)定义:在一定条件下,难溶电解质的饱和溶液中存在沉淀溶解平衡,其即为溶度积常数或溶度积,符号为。(2)表达式:对于沉淀溶解平衡AmBn(s)mAn+(aq)+nBm-(aq),则有Ksp=。(3)影响因素:同一难溶电解质的Ksp仅仅是的函数,不变,Ksp不变。【举题说法】例题1下列有关AgCl沉淀溶解平衡的说法不正确的是()A.AgCl沉淀的生成和溶解仍在不断地进行,但二者速率相等B.向AgCl饱和溶液中加入NaCl固体,AgCl的Ksp减小C.升高温度,AgCl的溶解度增大D.加入水,平衡向AgCl溶解的方向移动【答案】B【解析】达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解仍在不断进行,是动态平衡,速率相等,A项正确;Ksp只与温度有关,温度不变Ksp不变,不随浓度的改变而改变,B项错误;升高温度氯化银的溶解度增大,C项正确;加水稀释时,c(Ag+)、c(Cl-)均减小,平衡正向移动,即平衡向AgCl溶解的方向移动,D项正确。变式1一定温度下,溴化银在水中的沉淀溶解平衡曲线如右下图。下列说法正确的是()A.向溴化银的浊液中加入溴化钠溶液,溴化银的Ksp减小B.图中a点对应的是不饱和溶液C.向c点的溶液中加入0.1mol·L-1AgNO3,则c(Br-)减小D.升高温度可以实现c点到b点的转化【答案】BC【解析】溶液的温度不变,所以Ksp不变,A错误;a点,c(Br-)·c(Ag+)Ksp,溶液处于过饱和状态,平衡向析出沉淀的方向移动,直至Qc=Ksp。考点2沉淀溶解平衡的应用【基础梳理】1.沉淀的生成:如要除去CuCl2溶液中的FeCl3,可向溶液中加入或。2.沉淀的溶解:如要使Mg(OH)2沉淀溶解,可加入。3.沉淀的转化:锅炉除垢,将CaSO4转化为CaCO3的离子方程式为;ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀的离子方程式为。【举题说法】例题2实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是()A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶【答案】B【解析】难溶物质在溶液中存在沉淀溶解平衡,A项正确;溶液中存在沉淀溶解平衡,滤液中含有Ag+,B项错误;沉淀由白色变为黄色,说明生成AgI,反应向生成更难溶沉淀的方向进行,C、D项正确。变式2化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是()A.MnS的Ksp比CuS的Ksp大B.该反应达到平衡时,c(Cu2+)=c(Mn2+)C.往...