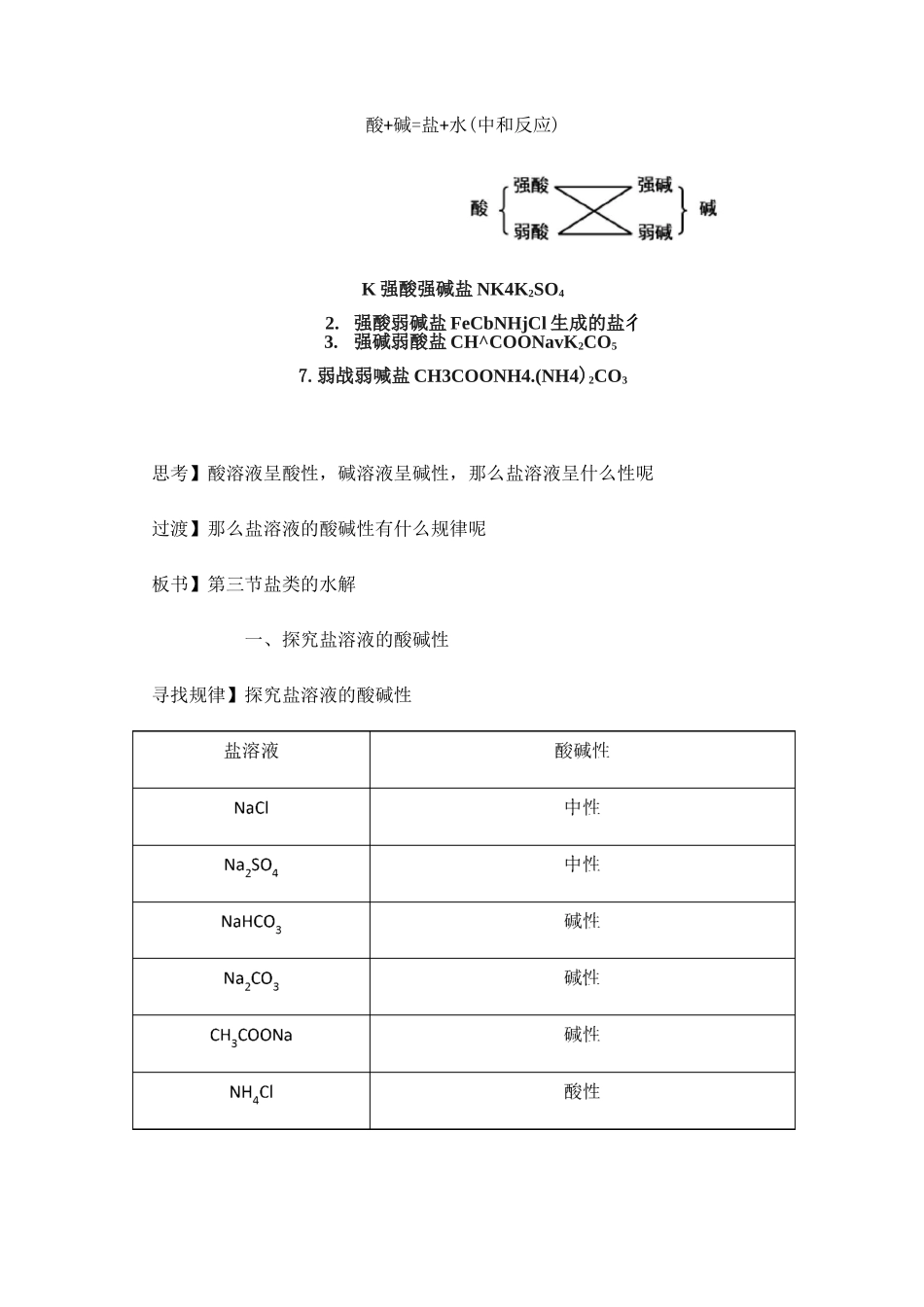
盐溶液的酸碱性及原因【教学目标】知识与技能1.掌握盐类水解的概念;以CH3COONa、NH4CI为例理解盐类水解的原理。2.理解盐类水解的特点和规律。过程和方法1.通过实验探究、分组讨论,进一步让学生掌握“提出问题-分析问题-理论解释-解决问题”的科学方法。2.通过问题探索,培养学生解决实际问题的能力。情感、态度和价值观1.通过“盐溶液不一定显中性”的教学,让学生知道全面看事物的辩证思想。2.培养学生实事求是、科学探索的精神。【教学重点】盐类水解的概念、原理和规律【教学难点】理解盐类水解的原理教学过程:【引入】生活中常用的添加剂除了食盐(NaCI)夕卜,还有味精(C5H8NO4Na),苏打(Na2COJ,小苏打(NaHCO3)等,这些都属于化学中的盐类。这节课我们来学习有关盐类的一些知识——盐类的水解。【知识回顾】根据形成盐的酸、碱的强弱来分,盐可以分成哪几类酸+碱=盐+水(中和反应)K强酸强碱盐NK4K2SO42.强酸弱碱盐FeCbNHjCl生成的盐彳3.强碱弱酸盐CH^COONavK2CO57.弱战弱喊盐CH3COONH4.(NH4)2CO3思考】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呈什么性呢过渡】那么盐溶液的酸碱性有什么规律呢板书】第三节盐类的水解一、探究盐溶液的酸碱性寻找规律】探究盐溶液的酸碱性(N^bSOq酸性从以上的实验中,我们发现有的盐溶液呈中性,有的盐溶液呈酸性,有的盐溶液呈碱性。【思考】试用归纳法找出盐的组成(分类)与盐溶液酸碱性的关系。盐的类型与盐溶液酸碱性的关系:盐溶液组成分类酸碱性NaCI强酸强碱盐中性M2SO4NaHCO3强碱弱酸盐碱性Na?—CH3COONaNH4CI强酸弱碱盐酸性(NHJ2SO4【小结】强酸强碱盐呈中性,强酸弱碱盐呈酸性,强碱弱酸盐呈碱性。【思考】为什么盐溶液会呈现不同的酸碱性这节课我们就来研究这个问题【板书】二、盐溶液呈现不同酸碱性的原因【探究原因】盐溶液呈现不同酸碱性的原因纯水中,当分别加入CH3COONa、NH4CI、NaCI形成溶液后,请思考:、NH4Cl、NaCl是什么类型的电解质2.它们在水中各以什么形式存在3.其水溶液中各存在哪些微粒4.这些微粒能相互反应吗5.若反应,结果怎么样【讲】以CH3COONa溶液为例分析强碱弱酸盐溶液呈碱性的原因。我们把CH3COONa溶于水之后,溶液中存在以下两个电离平衡:【投影】H2O=^H++OH-(1)CH3COONa=CH3COO-+Na+(2)【讲】我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,那么就一定有CH3COOH生成,消耗了水中的H+,促进了水的电离,溶液中的C(H+)VC(OH-),溶液呈碱性。【投影】1、弱酸强碱盐,水解显碱性CH3COONa=CH3COO-+Na++H2OH++OH-ICH3COOH水解方程式:CH3COONa+H2O=^CH3COOH+NaOH离子方程式:CH3COO-+H2O=^CH3COOH+OH-【讲】从离子方程式可知,醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。【思考与交流】NH4CI溶液中存在那些电离溶液中那些离子间相互作用使溶液呈酸性【投影】2、强酸弱碱盐水解NH4CI=NH4++CI-+H2O一^OH-+H+NH3・H2O水解方程式:NH4CI+H2O一^NH3•H2O+HCl离子方程式:NH4++H2O一^NH3•H2O+H+【问】由上可知,强碱弱酸盐水解使溶液显碱性,强酸弱碱盐水解使溶液显酸性。那么强酸强碱盐会发生水解吗【讲】说得好!是不会。因为强酸强碱盐所电离出来的离子都不会和水电离出来的H+或OH-发生反应,比如NaCI,电离出来的Na+和Cl-都不会与水电离出来的H+或OH-反应,对水的电离平衡没有影响,C(H+)=C(OH-),溶液呈中性。【投影】3、强酸强碱盐:不水解【讲】根据刚才我们一起分析的各种盐在水溶液在的情况,大家思考:什么是盐的水解【板书】1、盐类水解:在溶液中盐电离出来的弱离子跟水所电离出来的H+或OH-结合生成弱酸、弱碱的反应,叫做盐类的水解。【讲】在溶液中盐电离出来的弱离子跟水所电离出来的H+或0H-结合生成弱酸弱碱的反应,叫做盐类的水解。这就是盐溶液呈现不同酸碱性的原因。【思考】结合盐类水解的定义及盐的组成、盐溶液的酸碱性分析盐类水解的条件、实质是什么有什么规律【板书】2.水解的条件:易溶于水、在水溶液中电离出弱酸阴离子或弱碱阳离子。3.盐类水解的实质:破坏了水的电离平衡,促进了水的电离。4.盐类水解...