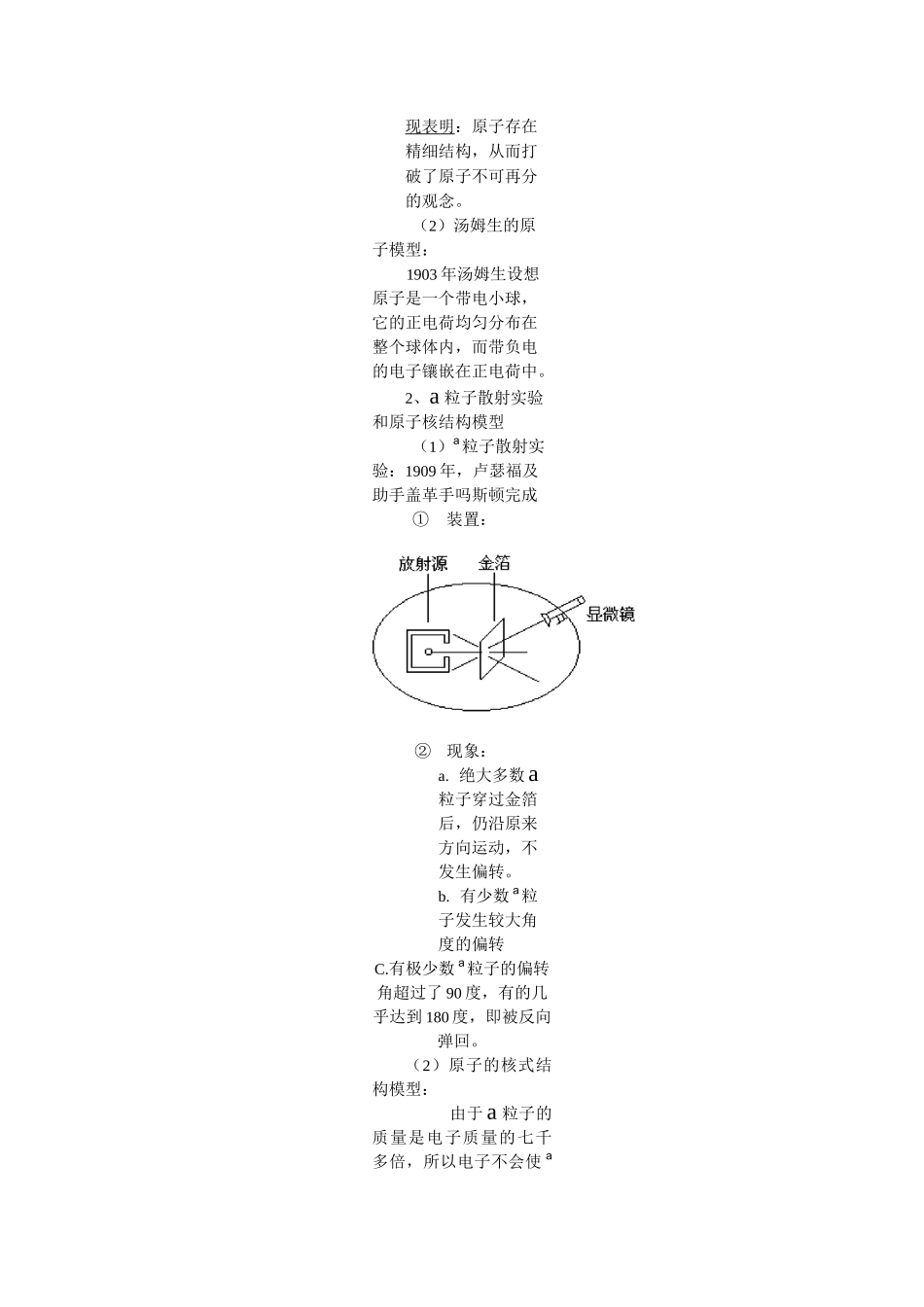
原子核的组核式结构与经典电磁理论的矛盾「核反应波尔原子理论十九、近代物理*原子结构电子的发现(1897)汤姆生“蛋糕式”原子结构模型a粒子散射(1909)卢瑟福核式结构模型(1911)二、画龙点睛概念一、原子结构:1、电子的发现和汤姆生的原子模型:(1)电子的发现:1897年英国物理学家汤姆生,对阴极射线进行了一系列的研究,从而发现了电子。电子的发―、知识网络原子物理VVvV现表明:原子存在精细结构,从而打破了原子不可再分的观念。(2)汤姆生的原子模型:1903年汤姆生设想原子是一个带电小球,它的正电荷均匀分布在整个球体内,而带负电的电子镶嵌在正电荷中。2、a粒子散射实验和原子核结构模型(1)a粒子散射实验:1909年,卢瑟福及助手盖革手吗斯顿完成①装置:②现象:a.绝大多数a粒子穿过金箔后,仍沿原来方向运动,不发生偏转。b.有少数a粒子发生较大角度的偏转C.有极少数a粒子的偏转角超过了90度,有的几乎达到180度,即被反向弹回。(2)原子的核式结构模型:由于a粒子的质量是电子质量的七千多倍,所以电子不会使a粒子运动方向发生明显的改变,只有原子中的正电荷才有可能对a粒子的运动产生明显的影响。如果正电荷在原子中的分布,像汤姆生模型那模均匀分布,穿过金箔的a粒了所受正电荷的作用力在各方向平衡a粒了运动将不发生明显改变。散射实验现象证明,原子中正电荷不是均匀分布在原子中的。1911年,卢瑟福通过对a粒子散射实验的分析计算提出原子核式结构模型:在原子中心存在一个很小的核,称为原子核,原子核集中了原子所有正电荷和几乎全部的质量,带负电荷的电子在核外空间绕核旋转。原子核半径小于10-14m,原子轨道半径约10-10m。3、玻尔的原子模型(1)原子核式结构模型与经典电磁理论的矛盾(两方面)a.电子绕核作圆周运动是加速运动,按照经典理论,加速运动的电荷,要不断地向周围发射电磁波,电子的能量就要不断减少,最后电子要落到原子核上这与原子通常是稳定的事实相矛盾。b.电子绕核旋转时辐射电磁波的频率应等于电子绕核旋转的频率,随着旋转轨道的连续变小,电子辐射的电磁波的频率也应是连续变化,因此按照这种推理原子光谱应是连续光谱,这种原子光谱是线状光谱事实相矛盾。(2)玻尔理论上述两个矛盾说明,经典电磁理论已不适用原子系统,玻尔从光谱学成就得到启发,利用普朗克的能量量了化的概念,提了三个假设:①定态假设:原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的,电子虽然做加速运动,但并不向外在辐射能量,这些状态叫定态。②跃迁假设:原子从一个定态(设能量为E2)跃迁到另一定态(设能量为E1)时,它辐射成吸收一定频率的光子光子的能量由这两个定态的能量差决定,即hv=E2-E1③轨道量子化假设,原子的不同能量状态,跟电子不同的运行轨道相对应。原子的能量不连续因而电子可能轨道的分布也是不连续的。即轨道半径跟电子动量mv的乘积等于h/2兀的整数倍,即:轨道半径跟电了动量mv的乘积等于h/2兀的整数倍,即mvr=nn=1、2、32兀n为正整数,称量数数(3)玻尔的氢子模型:为:n\n=1、2、①氢原子的能级公式和轨道半径公式:玻尔在三条假设基础上,利用经典电磁理论和牛顿力学,计算出氢原子核外电子的各条可能轨道的半径,以及电子在各条轨道上运行时原子的能量,(包括电子的动能和原子的热能。)氢原子中电子在第几条可能轨道上运动时,氢原子的能量E,和电子轨道半径r分别nnr=n2rn1其中E]、r1为离核最近的第一条轨道(即n=1)的氢原子能量和轨道半径。即:E=-13.6ev,r]=0.53X10-10m(以电子距原子核无穷远时电势能为零计算)②氢原子的能级图:氢原子的各个定态的能量值,叫氢原子的能级。按能量的大小用图开像的表示出来即能级图。M=CO0M=4-0.85evH=3-1.51ev23.4evn=1其中n=1的定态称为基态。n=2以上的定态,称为激发态。③玻尔理论的局限性。由于引进了量子理论(轨道量子化和能量量子化),玻尔理论成功地解释了氢光谱的规律。但由于它保留了过多的经典物理理论(牛顿第二定律、向心力、库仑力等),所以在解释其他原③h(V1+V2);④h(V子的光谱上都遇到很大的困难。例题:用光子能量为E的单色光照射容器...