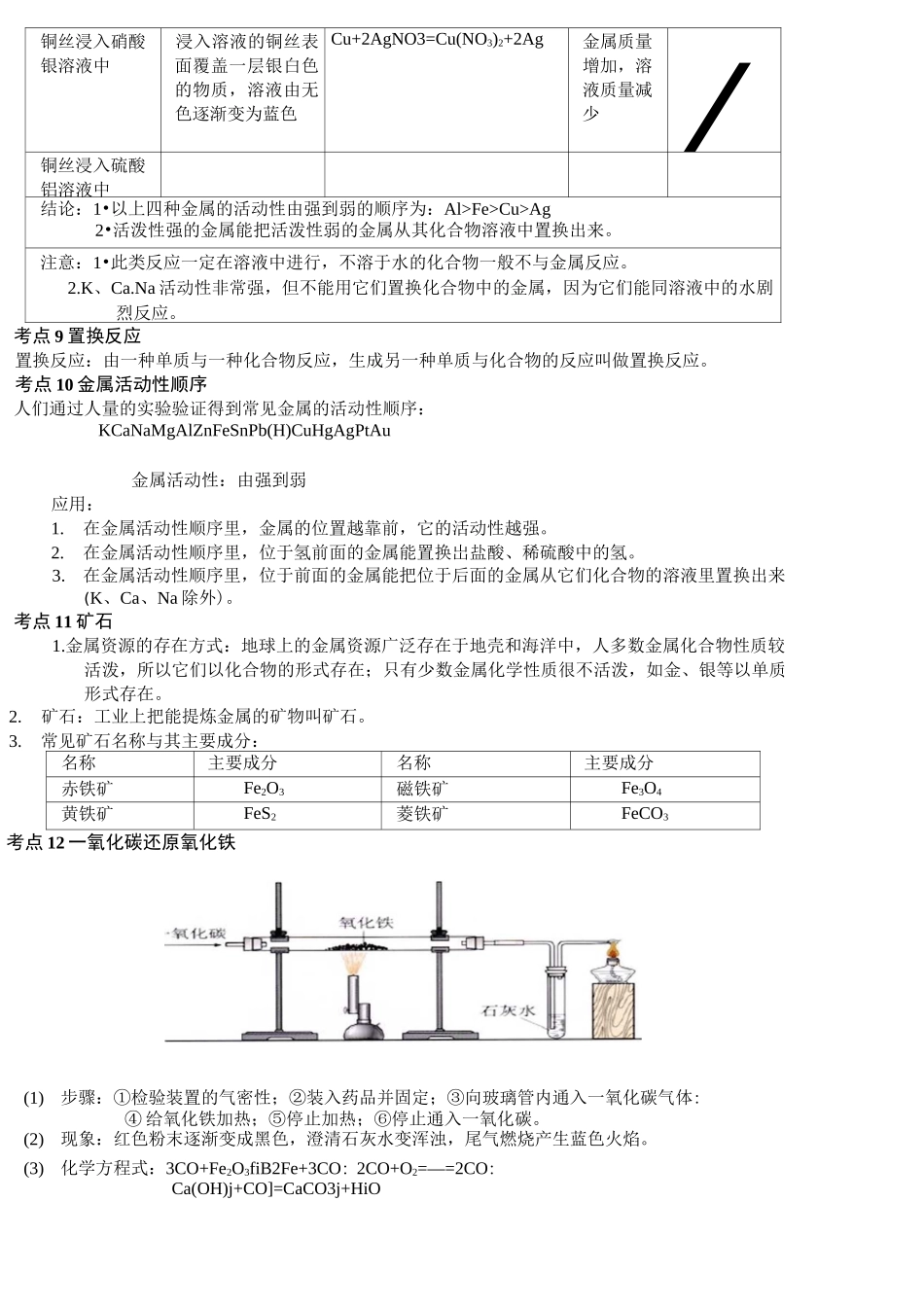
第八单元金属和金属材料考点1金属材料包括纯金属和合金两类。金属属于金属材料,但金属材料不一定是纯金属,也町能是合金。考点2金属材料的发展史商朝,人们开始使用青铜器;春秋时期开始冶铁;战国时期开始炼钢;铜和铁一直是人类广泛应用的金属材料。在100多年前,又开始了铝的使用,因铝具有密度小和抗腐蚀等许多优良性能,铝的产量己超过了铜,位于第二位。考点3金属的物理性质1•共性:人多数金属都具有金属光泽,密度和硬度较大,熔沸点较高,具有良好的延展性和导电、导热性。在室温下除汞为液体,其余金属均为固体。2•—些金属的特性:铁、铝等大多数金属都呈银白色,铜呈紫红色,金呈黄色;常温下人多数金属都是固体,汞却是液体:各种金属的导电性、导热性、密度、熔点、硬度等差异较人;银的导电性和导热性最好,餌的熔点最高,汞的熔点最低,馅的硬度最人。考点4物质的性质与物质的用途之间的关系1•物质的性质决定物质的用途,而物质的用途又反映出物质的性质。2•物质的性质很大程度上决定了物质的用途。但这不是唯一的决定因素,在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环紧的影响等多种因素。考点5合金1.合金:在金属中加热熔合某些金属和非金属,形成具有金属特性的物质。注意:(1)合金是金属与金属或金属与非金属的混合物。(2)合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。(3)口常使用的金属材料,人多数为合金。(4)金属在熔合了其它金属和非金属后,不仅组成上发生了变化,其内部组成结构也发生了改变,从而引起性质的变化。2•合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成合金时)。3•合金与组成它们的纯金属性质比较。下面是黄铜和铜片,焊锡和锡,铝合金和铝线的有关性质比较:性质比较黄铜铜焊锡锡铝合金铝光泽与颜色黄色紫红色深灰色银白色银白色银白色有光泽有光泽有光泽有光泽有光泽有光泽硬度比铜大坚韧硕度人质软坚硕质软熔点比铜低较高比锡低较低比铝低较高4•几种常见合金(1)铁合金:主要包括生铁和钢,它们的区别是含碳量不同,生铁含碳量2%43%,钢的含碳量为0.03%—2%。钢比生铁具有更多的优良性能,易于加工,用途更为广泛。(2)铝合金:铝中加入镁.铜、锌等金属形成合金。广泛应用于制造飞机、舰艇和载重汽车等,可增加它们的载重量以及提高运行速度,并具有抗海水腐蚀、避磁性等特点。(3)铜合金:黄铜:铜、锌的合金;青铜:铜、锡的合金;白铜:铜、線的合金。(4)钛和钛合金:被认为是21世纪的重要金属材料。性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度人,密度小。用途:喷气式发动机、飞机机身、人造卫星外壳、火箭壳体、医学补形、造纸、人造骨.海水淡化设备、海轮、舰梃的外壳等。考点6金属与氧气的反应金属条件反应方程式现象Mg常温下(在空气中2Mg+O:=2MgO银白色镁条在空气中表面逐渐变暗,生成白色固体。点燃时(在空气中或在氧气中)占燃2Mg+O2===2MgO剧烈燃烧,发出耀眼的白光,生成一种白色固体。Al常温下(在空气4AR3O2=2A12O3银白色的表面逐渐变暗,生成一层致密的中)薄膜点燃时(在氧气中)4A1+3O:=^=2A1O剧烈燃烧,放热和縫眼的白光,生成白色固体。Fe常温卞,干燥的空气一常温匚在潮湿的空气中铁与空气中的氧气和水共同作用卞会生成暗红色疏松的物质一一铁锈(FSO3・HO)在氧气中点燃3Fe+2O2^^-Fe3O4剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。Cu常温|、・,干燥的空气—一加热时26+0】A260铜丝表面逐渐变为黑色在潮湿的空气中2CU+O2+CO2+H2O=CU2(OH)2CO3铜表面生成一层绿色物质Au、Ag即使在高温下也不与氧气反应“真金不怕火炼”。结论:人多数金属都能与氧气反应,但反应的难易和剧烈程度不同。Mg、Al等在常温下就能与氧气反应:Fe、Cu等在常温卞几乎不能单独与氧气反应,但在点燃或加热的情况下可以发生反应;Au、Ag等在高温时也不与氧气反应。考点7金属与酸的反应金属现彖反应的化学方程式稀盐酸稀硫酸稀盐酸稀硫酸镁剧烈反应,产生人量气泡,溶液...