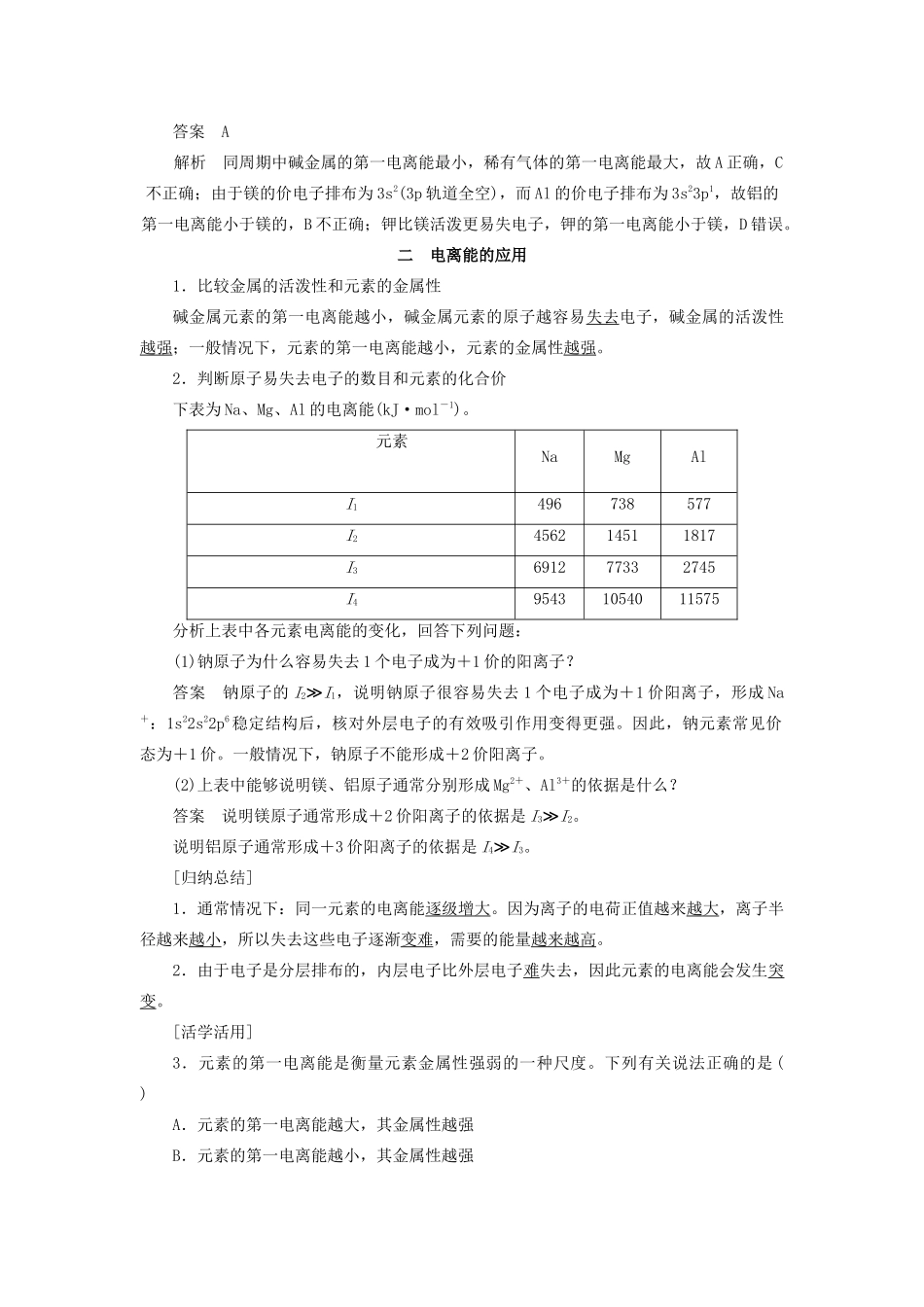
第1课时电离能及其变化规律[学习目标定位]1.知道原子结构与元素性质间的关系规律。2.正确理解元素电离能的含义及其变化规律,会用电离能的概念分析解释元素的某些性质。一元素的电离能及其变化规律1.元素的电离能(1)电离能的概念:气态原子或气态离子失去一个电子所需要的最小能量叫做电离能,常用符号I表示,单位为kJ·mol-1。电离能越小,表示在气态时该原子越容易失去电子;反之,电离能越大,表示在气态时该原子越难失去电子。(2)第一电离能是处于基态的气态原子失去一个电子,生成+1价气态阳离子所需要的能量,符号为I1。M(g)===M+(g)+e-I1原子为基态时,失去电子时消耗的能量最低。(3)第二电离能是由+1价气态阳离子再失去一个电子形成+2价气态阳离子所需要的能量,符号为I2。依次还有第三电离能I3,第四电离能I4等。M+(g)===M2+(g)+e-I2M2+(g)===M3+(g)+e-I3同一元素的电离能按I1、I2、I3……顺序,变化规律是依次增大。2.元素第一电离能变化规律(1)元素第一电离能的变化趋势如下图所示:(2)观察分析上图,回答下列问题:①同一周期元素的第一电离能有怎样的变化规律?其原因是什么?答案同一周期,从左到右,第一电离能总体上逐渐增大,表示元素原子越来越难失去电子。原因:随着核电荷数增大,原子半径逐渐减小,核对外层电子的有效吸引作用依次增强。②同一主族元素的第一电离能有怎样的变化规律?其原因是什么?答案同一主族,自上而下,第一电离能逐渐减小,表明元素原子越来越容易失去电子。原因:同主族元素原子的价电子数相同,原子半径逐渐增大,原子核对核外电子的有效吸引作用逐渐减弱。③过渡元素的第一电离能变化有何特点?其原因是什么?答案过渡元素的第一电离能变化不太规则,同一周期,从左到右,第一电离能略有增加。原因:对这些元素的原子来说,增加的电子大部分排布在(n-1)d或(n-2)f轨道上,原子核对外层电子的有效吸引作用变化不是太大。④氮、磷、镁、锌等元素的第一电离能的变化出现反常的原因是什么?答案能量相同的轨道具有全充满、半充满及全空的电子构型的元素稳定性较高,其第一电离能数值较大。如稀有气体的电离能在同周期元素中最大,N、P的p轨道为半充满,Mg的p轨道为全空状态,Zn的d轨道为全充满,其第一电离能均比同周期相邻元素大。[归纳总结]1.电离能数值的大小主要取决于原子的核电荷数、原子半径及原子的电子构型。2.同周期元素,随着Z增大,I1增大。碱金属元素的第一电离能最小。稀有气体元素的第一电离能最大。同主族元素,随着n增大,I1减小。3.当相邻逐级电离能突然变大时说明电子的电子层发生了变化,即同一电子层中电离能相近,不同电子层中电离能有很大的差距。[活学活用]1.下列说法中不正确的是()A.同族元素,随着电子层数的增加,I1逐渐增大B.同周期元素,随着核电荷数的增加,I1逐渐增大C.通常情况下,电离能I1