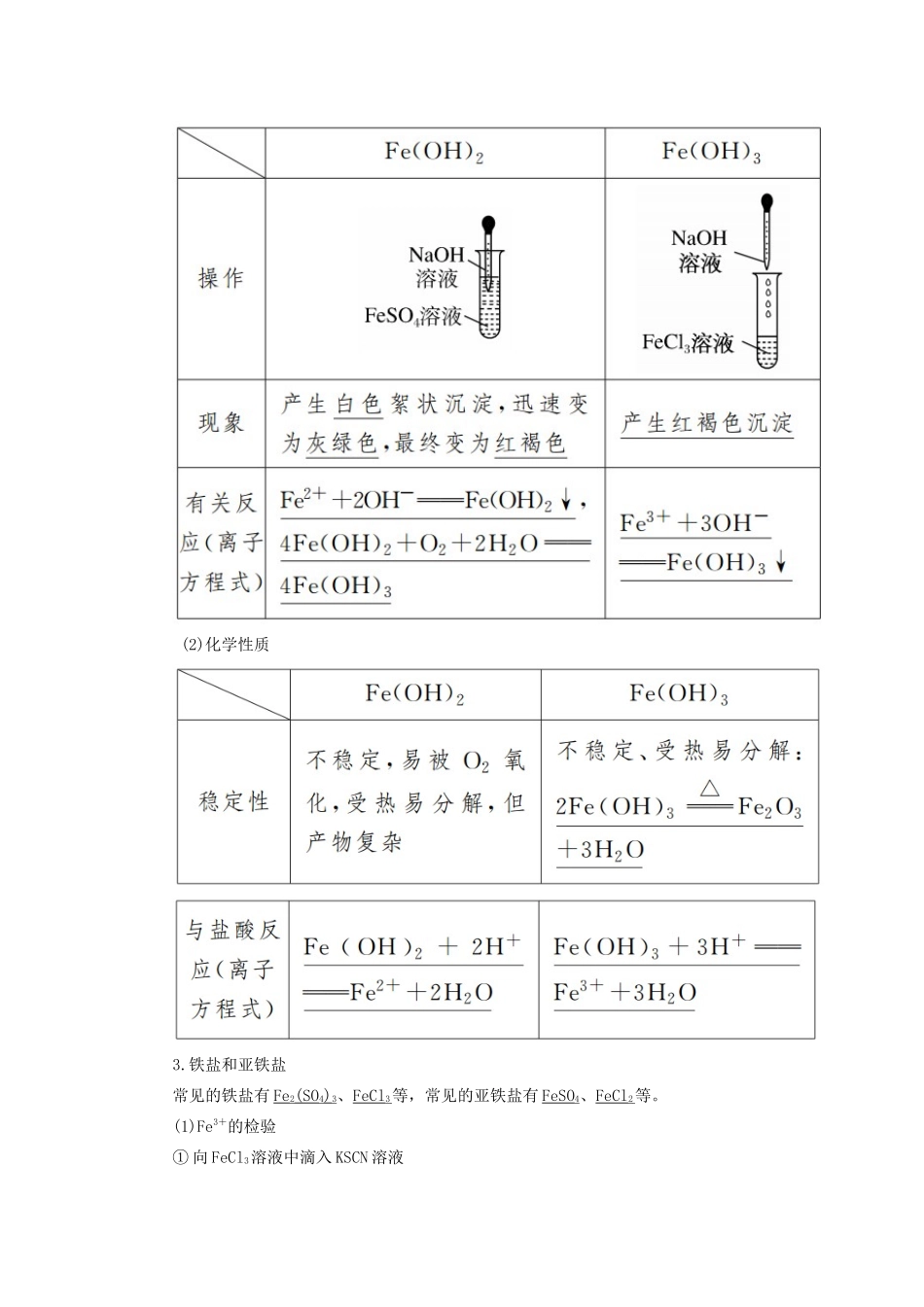
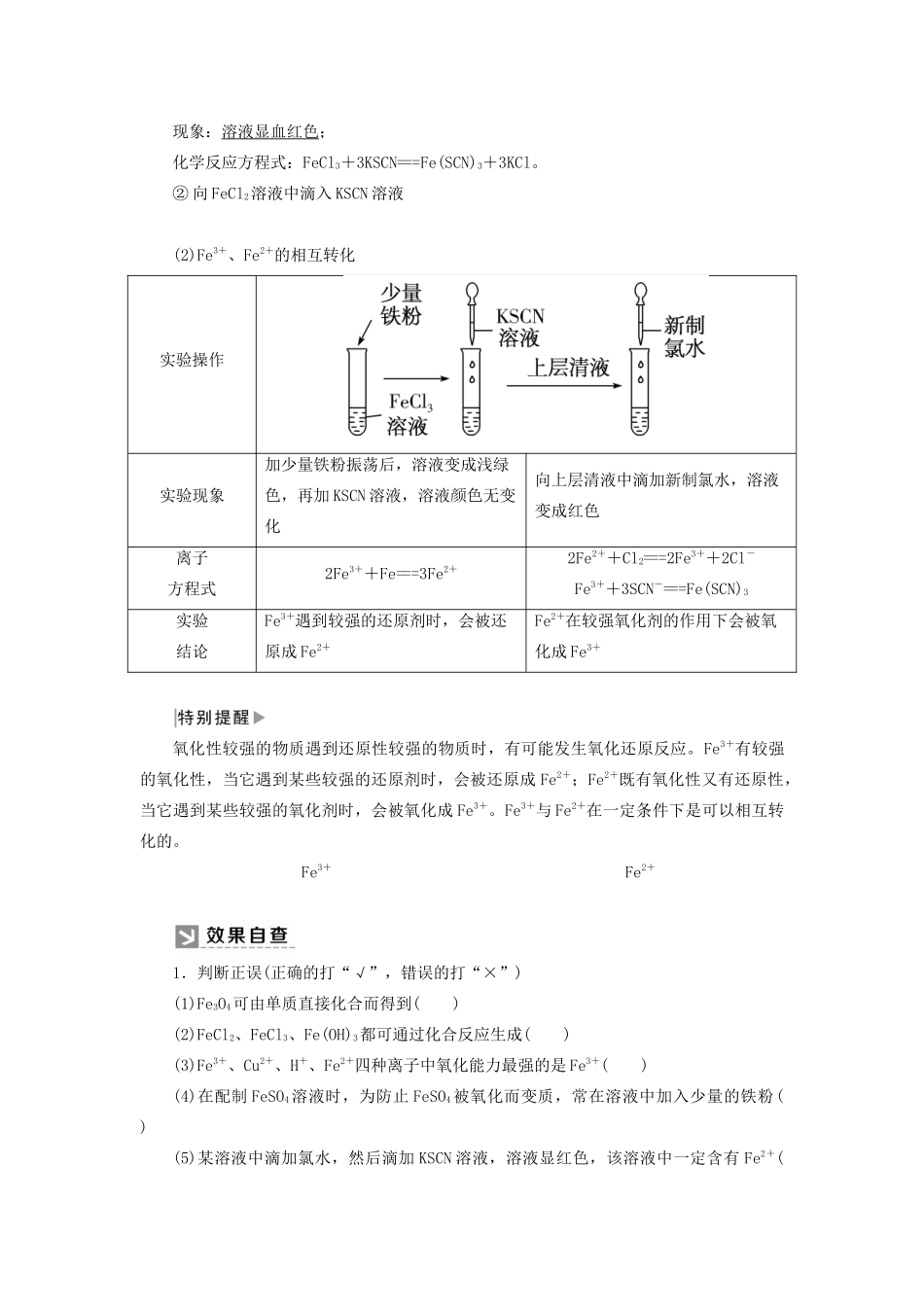
第二课时铁的重要化合物学习目标:1.了解铁的氧化物的性质及应用。2.了解Fe(OH)2、Fe(OH)3的制备原理及化学性质。3.掌握Fe2+、Fe3+间的相互转化以及Fe3+、Fe2+的检验方法。1.铁的氧化物(1)物理性质(2)化学性质①氧化亚铁不稳定,在空气中受热易被氧化为Fe3O4。②氧化亚铁和氧化铁属于碱性氧化物,与非强氧化性酸反应生成Fe2+和Fe3+。③写出氧化亚铁和氧化铁分别与盐酸反应的离子方程式:a.氧化亚铁:FeO+2H+===Fe2++H2O。b.氧化铁:Fe2O3+6H+===2Fe3++3H2O。(3)主要用途氧化铁俗称铁红,常用作红色油漆和涂料。2.铁的氢氧化物(1)铁的氢氧化物的制备(2)化学性质3.铁盐和亚铁盐常见的铁盐有Fe2(SO4)3、FeCl3等,常见的亚铁盐有FeSO4、FeCl2等。(1)Fe3+的检验①向FeCl3溶液中滴入KSCN溶液现象:溶液显血红色;化学反应方程式:FeCl3+3KSCN===Fe(SCN)3+3KCl。②向FeCl2溶液中滴入KSCN溶液(2)Fe3+、Fe2+的相互转化实验操作实验现象加少量铁粉振荡后,溶液变成浅绿色,再加KSCN溶液,溶液颜色无变化向上层清液中滴加新制氯水,溶液变成红色离子方程式2Fe3++Fe===3Fe2+2Fe2++Cl2===2Fe3++2Cl-Fe3++3SCN-===Fe(SCN)3实验结论Fe3+遇到较强的还原剂时,会被还原成Fe2+Fe2+在较强氧化剂的作用下会被氧化成Fe3+氧化性较强的物质遇到还原性较强的物质时,有可能发生氧化还原反应。Fe3+有较强的氧化性,当它遇到某些较强的还原剂时,会被还原成Fe2+;Fe2+既有氧化性又有还原性,当它遇到某些较强的氧化剂时,会被氧化成Fe3+。Fe3+与Fe2+在一定条件下是可以相互转化的。Fe3+Fe2+1.判断正误(正确的打“√”,错误的打“×”)(1)Fe3O4可由单质直接化合而得到()(2)FeCl2、FeCl3、Fe(OH)3都可通过化合反应生成()(3)Fe3+、Cu2+、H+、Fe2+四种离子中氧化能力最强的是Fe3+()(4)在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉()(5)某溶液中滴加氯水,然后滴加KSCN溶液,溶液显红色,该溶液中一定含有Fe2+()[答案](1)√(2)√(3)√(4)√(5)×2.下列说法不正确的是()A.铁的氧化物均为黑色固体,均难溶于水B.Fe(OH)2在空气中易变质,生成红褐色Fe(OH)3C.铁在氧气中剧烈燃烧,火星四射,生成黑色的Fe3O4D.氢氧化亚铁为白色絮状沉淀[解析]铁的氧化物有黑色FeO和Fe3O4以及红棕色Fe2O3均不溶于水,铁丝在氧气中燃烧生成Fe3O4,在空气中缓慢氧化生成Fe2O3;Fe(OH)2为白色絮状沉淀具有极强还原性,易被O2氧化生成红褐色Fe(OH)3。[答案]A知识点一铁的氧化物和氢氧化物1.铁的氧化物(1)Fe的常见化合价只有+2价和+3价,Fe3O4是黑色具有磁性的晶体,可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。(2)FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物,均不溶于水。(3)Fe3O4与盐酸反应可分别看作Fe2O3、FeO与盐酸反应,然后把两个反应式相加。Fe3O4+8HCl===2FeCl3+FeCl2+4H2O(4)从价态分析,FeO有还原性,Fe2O3有氧化性,Fe3O4既有氧化性又有还原性。但FeO与Fe2O3中Fe元素价态相邻,两者不会反应。FeO、Fe3O4遇氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。2.氢氧化物(1)Fe(OH)3红褐色,Fe(OH)2白色,均不溶于水。(2)Fe(OH)2具有强还原性,易被空气中的O2氧化生成Fe(OH)3。①转化过程中的特殊现象是:白色沉淀迅速变成灰绿色,最终变成红褐色。②转化方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3反应类型属于化合反应。(3)Fe(OH)2、Fe(OH)3受热均分解生成同价态的氧化物。【典例1】用足量的CO还原32.0g某种氧化物,将生成的气体通入足量的澄清石灰水中,得到60g沉淀,则该氧化物是()A.FeOB.Fe2O3C.CuOD.Fe3O4[思路启迪]解决本题的关键是准确把握氧化还原反应过程的元素守恒,并灵活运用n1/n2=N1/N2确定化学式。[解析]由生成CaCO360g可得反应掉CO为0.6mol,即32g金属氧化物中含氧原子为0.6mol,铁原子:=0.4mol,N(Fe)∶N(O)=0.4∶0.6=2∶3,即氧化物为Fe2O3。[答案]B灵活运用守恒思想:由CO――→CO2――→CaCO3可知n(...