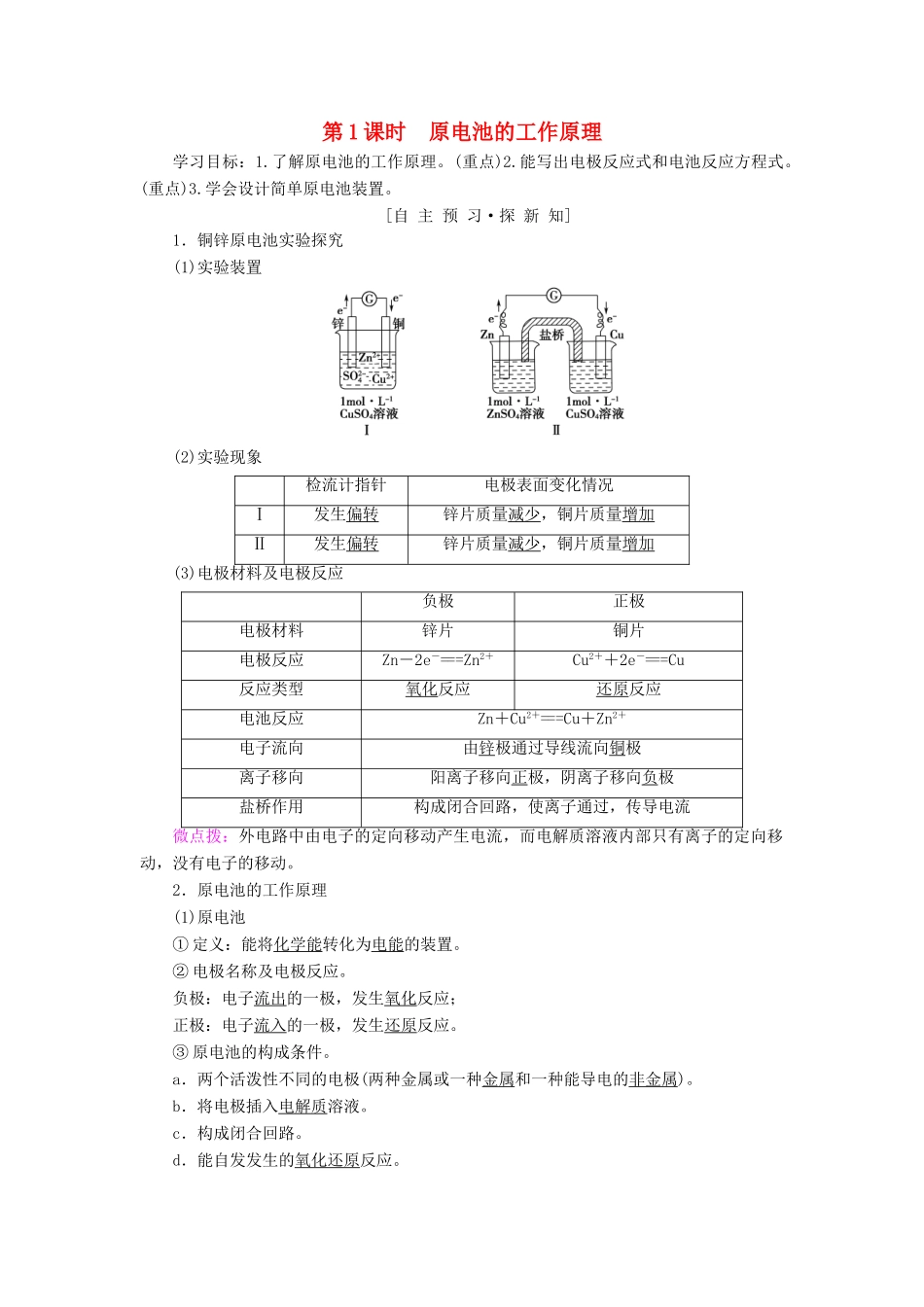
第1课时原电池的工作原理学习目标:1.了解原电池的工作原理。(重点)2.能写出电极反应式和电池反应方程式。(重点)3.学会设计简单原电池装置。[自主预习·探新知]1.铜锌原电池实验探究(1)实验装置(2)实验现象检流计指针电极表面变化情况Ⅰ发生偏转锌片质量减少,铜片质量增加Ⅱ发生偏转锌片质量减少,铜片质量增加(3)电极材料及电极反应负极正极电极材料锌片铜片电极反应Zn-2e-===Zn2+Cu2++2e-===Cu反应类型氧化反应还原反应电池反应Zn+Cu2+===Cu+Zn2+电子流向由锌极通过导线流向铜极离子移向阳离子移向正极,阴离子移向负极盐桥作用构成闭合回路,使离子通过,传导电流微点拨:外电路中由电子的定向移动产生电流,而电解质溶液内部只有离子的定向移动,没有电子的移动。2.原电池的工作原理(1)原电池①定义:能将化学能转化为电能的装置。②电极名称及电极反应。负极:电子流出的一极,发生氧化反应;正极:电子流入的一极,发生还原反应。③原电池的构成条件。a.两个活泼性不同的电极(两种金属或一种金属和一种能导电的非金属)。b.将电极插入电解质溶液。c.构成闭合回路。d.能自发发生的氧化还原反应。(2)工作原理外电路中电子由负极流向正极;内电路(电解质溶液)中阴离子移向负极,阳离子移向正极;电子发生定向移动从而形成电流,实现了化学能向电能的转化。[基础自测]1.判断对错(对的在括号内打“√”,错的在括号内打“×”。)(1)所有的氧化还原反应都可以设计成原电池。()(2)原电池中,负极材料一定比正极材料活泼。()(3)原电池工作时,负极发生氧化反应。()(4)原电池中,电流从负极经导线流向正极。()(5)铜锌原电池中,溶液中的阳离子移向锌极。()[提示](1)×自发的氧化还原反应才能设计成原电池。(2)×原电池的负极材料不一定比正极材料活泼,如Mg-Al-NaOH(aq)原电池中,Al作负极。(3)√(4)×原电池中,电流由正极经导线流向负极。(5)×铜锌原电池中,Cu2+移向铜极。2.如图所示的装置能够组成原电池的是()B[A项,两电极材料相同;C项,不能形成闭合回路;D项,为电解池。][教师备选]下列反应,不可以设计成原电池的是()A.2FeCl3+Cu===2FeCl2+CuCl2B.NaOH+HCl===NaCl+H2OC.2Fe+3Br2===2FeBr3D.2KMnO4+5SO2+2H2O===K2SO4+2MnSO4+2H2SO4B[NaOH+HCl===NaCl+H2O不属于氧化还原反应,故不能设计成原电池。]3.据图分析,下列有关该原电池的叙述正确的是()A.工作时,盐桥中的K+会移向CuSO4溶液B.取出盐桥后,检流计指针依然发生偏转C.铜电极上有气泡逸出D.反应前后铜电极的质量不变A[在该原电池中,Zn作负极,Cu作正极,阳离子移向正极,A项正确;取出盐桥后,不能构成原电池,故检流计指针不发生偏转,B项错误;Cu电极为正极,电极反应式为Cu2++2e-===Cu,无气泡逸出,且铜电极的质量增加,C、D项错误。][合作探究·攻重难]原电池的构成条件1799年,意大利科学家伏特发明了世界上最早的电池——伏特电池。1836年,英国科学家丹尼尔对“伏特电池”进行了改良,制造了一个能稳定工作的铜锌原电池,称为“丹尼尔电池”。其基本构造如图所示。[思考交流]1.该装置中电子移动方向如何?溶液中的SO通过盐桥移向锌极吗?[提示]该原电池中负极是锌,正极是铜,电子由锌极流向铜极,盐桥中的K+向正极移动,Cl-向负极移动,从而平衡电荷,溶液中的SO不会通过盐桥移向锌极。2.取出盐桥,检流计指针还会偏转吗?[提示]取出盐桥,不能构成闭合回路,检流计指针不会偏转。3.将盐桥改为铜导线连接两种溶液,检流计指针还能偏转吗?[提示]将盐桥改为铜导线连接两种溶液,不能构成原电池,检流计指针不发生偏转。4.根据以上现象分析,盐桥起了什么作用?[提示]盐桥起到了使整个装置构成闭合回路的作用,同时能阻止反应物的直接接触。盐桥中Cl-向ZnSO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。[对点训练]题组一原电池的工作原理1.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是()A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO)减小C.电...