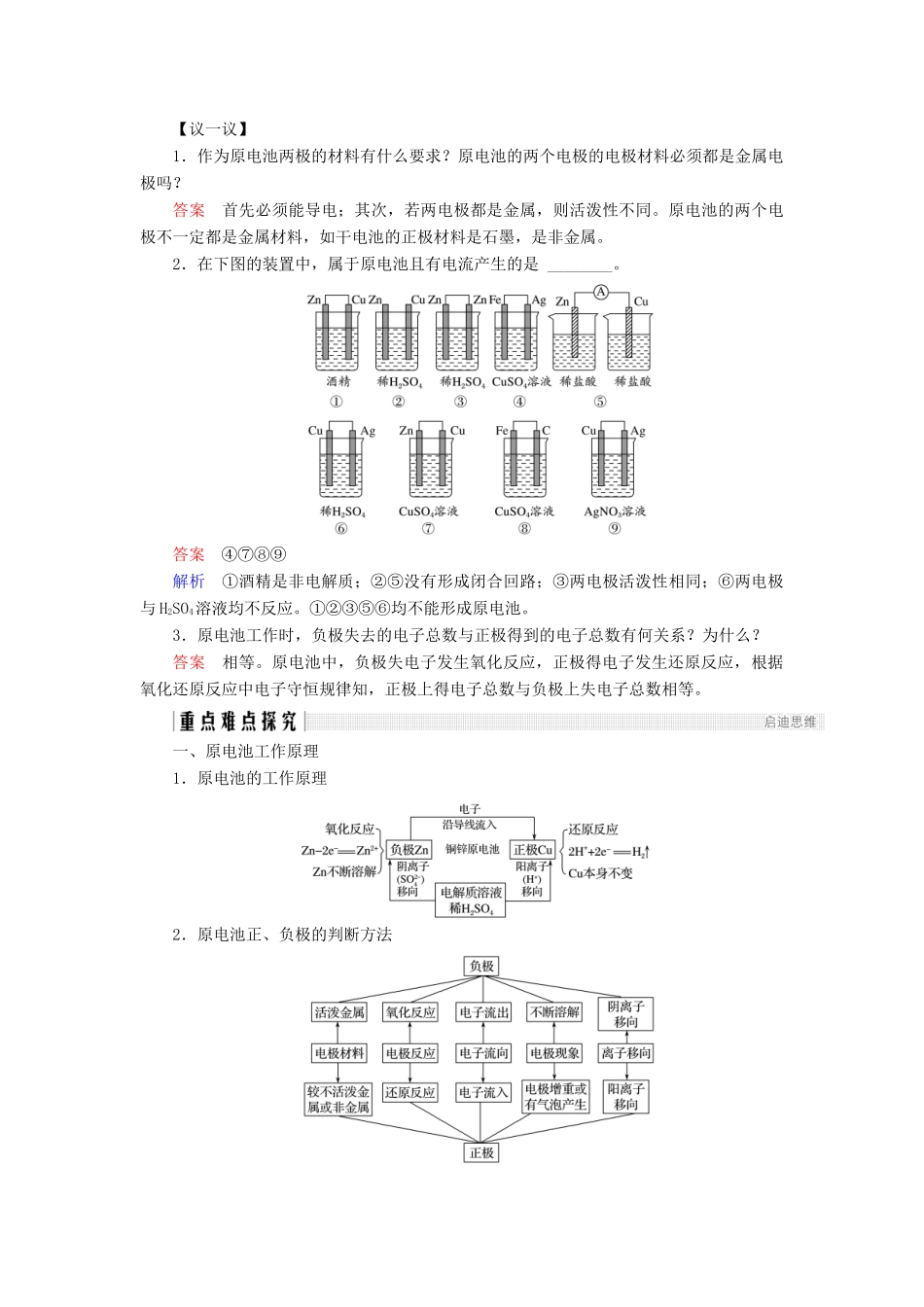
第2课时化学反应为人类提供能量[目标导航]1.了解化学反应中能量的转化形式。2.了解原电池的构成条件、工作原理和应用。3.了解常见的化学电源。一、化学能转化为热能1.放热反应和吸热反应(1)放热反应:化学反应过程产生的能量以热能的形式释放出来,像这样的反应属于放热反应。(2)吸热反应:化学反应需要不断地吸收热能来维持反应的进行,像这样的反应属于吸热反应。2.化学反应中的能量转化形式【议一议】1.如图为“即热饭盒”的结构示意图。这种饭盒使用起来非常方便,撤去底部的隔板几分钟后,饭菜就变热了,试从能量转化的角度说明其中的原理。答案在铁的催化作用下,镁跟水发生化学反应Mg+2H2O=====Mg(OH)2+H2↑,放出热量,即化学能转化为热能。2.铁路工人经常利用铝热剂来焊接钢轨,你能解释其中的原理吗?答案Fe2O3粉末和铝粉的混合物是常用的铝热剂。Fe2O3粉末和铝粉在较高温度下发生反应Fe2O3+2Al=====Al2O3+2Fe,放出大量的热,高温下铁呈液态,可焊接断裂的钢轨。二、化学能转化为电能1.探究原电池的工作原理实验步骤现象结论锌片逐渐溶解,表面有气泡锌与稀硫酸反应产生H2铜片表面无气泡铜与稀硫酸不反应锌片逐渐溶解锌失去电子铜片表面有气泡H+在Cu表面得到电子生成H2电流表指针发生偏转导线中有电子定向移动而产生电流两锌片逐渐溶解且表面都有气泡锌与稀硫酸反应电流表指针不偏转导线中无电流锌片无现象Zn、Cu与乙醇不反应铜片无现象电流表指针不偏转导线中无电流2.原电池(1)概念原电池是将化学能转化为电能的装置。(2)工作原理(以Zn—Cu原电池为例)电极材料锌铜电极名称负极正极电极反应Zn-2e-===Zn2+2H++2e-===H2↑反应类型氧化反应还原反应外电路电子流向由锌片沿导线流向铜片内电路离子移向溶液中H+向正极移动,在铜片上被还原为H2原电池总反应Zn+2H+===Zn2++H2↑(3)构成条件①本质→有自发进行的氧化还原反应;②电极→有活泼性不同的两个电极(金属与金属或金属与能导电的非金属);③溶液→两电极插入电解质溶液或熔融电解质;④回路→形成闭合回路(两电极接触或用导线连接)。(4)常见电池①干电池:又称一次电池,如锌锰电池。②蓄电池:又称二次电池,如铅蓄电池、镍氢电池、锂电池。③燃料电池:其能量转化率高,能长时间提供电能。如氢氧燃料电池。【议一议】1.作为原电池两极的材料有什么要求?原电池的两个电极的电极材料必须都是金属电极吗?答案首先必须能导电;其次,若两电极都是金属,则活泼性不同。原电池的两个电极不一定都是金属材料,如干电池的正极材料是石墨,是非金属。2.在下图的装置中,属于原电池且有电流产生的是________。答案④⑦⑧⑨解析①酒精是非电解质;②⑤没有形成闭合回路;③两电极活泼性相同;⑥两电极与H2SO4溶液均不反应。①②③⑤⑥均不能形成原电池。3.原电池工作时,负极失去的电子总数与正极得到的电子总数有何关系?为什么?答案相等。原电池中,负极失电子发生氧化反应,正极得电子发生还原反应,根据氧化还原反应中电子守恒规律知,正极上得电子总数与负极上失电子总数相等。一、原电池工作原理1.原电池的工作原理2.原电池正、负极的判断方法【关键提醒】判断原电池要“四看”一看本质:反应是自发进行的氧化还原反应。二看电极:具有两个活泼性不同的电极(燃料电池的电极一般是惰性电极)。三看溶液:电解质溶液(一般负极材料与电解质溶液反应)。四看回路:电极、电解质溶液构成闭合回路。【例1】如图是Zn和Cu形成的原电池,其实兴趣小组做完实验后,在读书卡片上记下结论。其中正确的一组是()①Zn为正极,Cu为负极②H+向负极移动③电子是由Zn经外电路流向Cu④Cu极上有H2产生⑤若有1mol电子流过导线,则产生的H2为0.5mol⑥正极的电极反应式为Zn-2e-===Zn2+A.①②③B.③④⑤C.④⑤⑥D.②③④解析在该原电池中,Zn比Cu活泼,故Zn为负极,Cu为正极,电子由Zn流出经导线流向Cu;负极反应为Zn-2e-===Zn2+,正极反应为2H++2e-===H2↑,故每转移1mol电子时,产生0.5molH2;在溶液中H+向正极移动,SO向负极移动。故①、②、⑥错误,③、④、⑤正确,选B项。答案B【方法拓展】判断电...