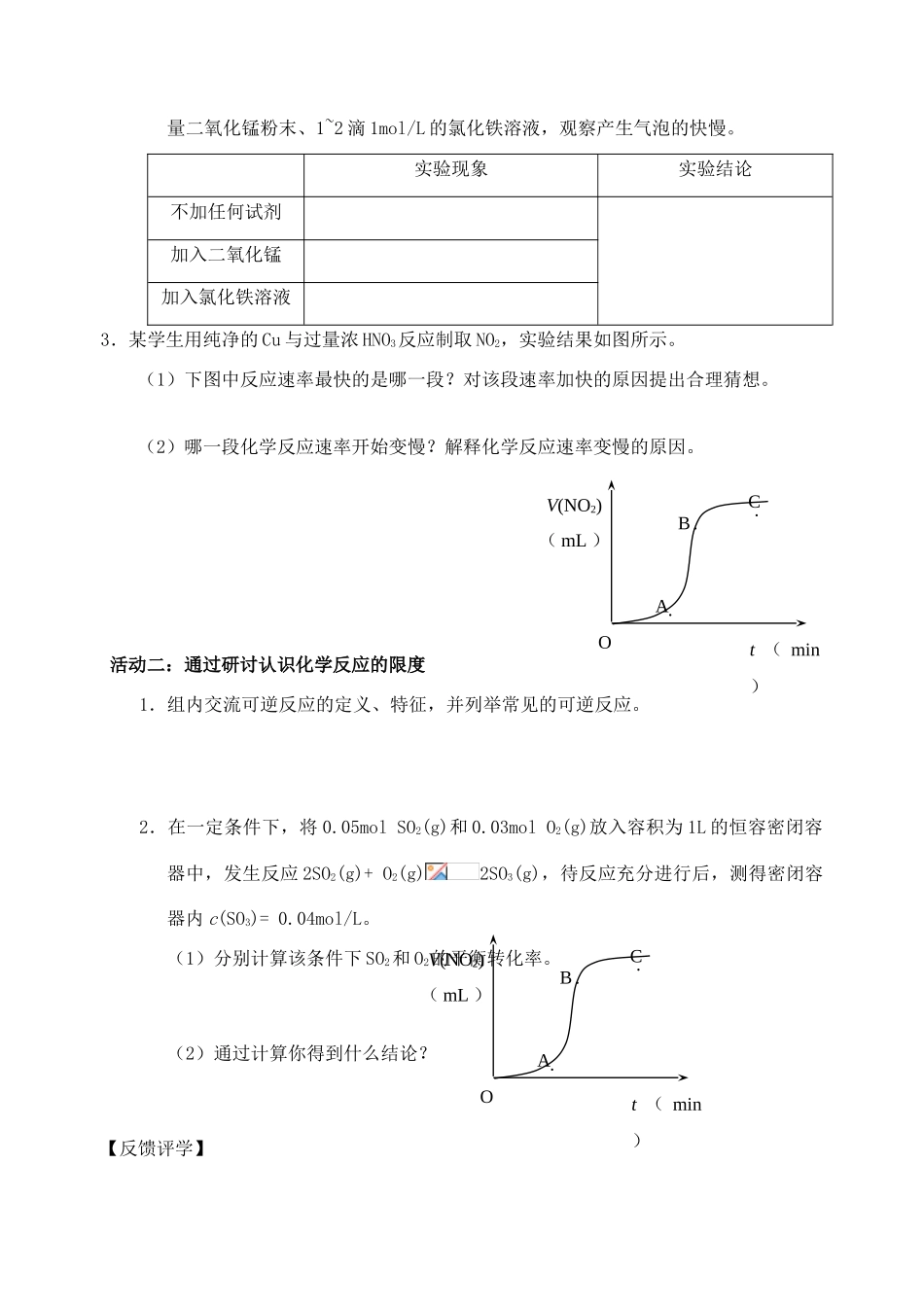
第三节化学反应的速率和限度【学习目标】1.通过实验认识化学反应的速率与限度。2.知道外界条件对化学反应速率的影响。【重点难点】化学反应速率的影响因素及其规律【活动方案】活动一:认识化学反应的速率1.列举化学反应快慢的实例,猜想影响化学反应速率的因素。2.实验探究化学反应速率的快慢。(1)取3支试管,各加入5mL3%、6%、15%的过氧化氢溶液,分别滴入1~2滴1mol/L的氯化铁溶液,观察产生气泡的快慢。实验现象实验结论3%的过氧化氢6%的过氧化氢15%的过氧化氢(2)取3支试管,各加入5mL6%的过氧化氢溶液,分别滴入1~2滴1mol/L的氯化铁溶液,将其中2支试管分别放入盛有冷水和热水的烧杯中,观察产生气泡的快慢。实验现象实验结论常温冷水中热水中(3)取3支试管,各加入5mL6%的过氧化氢溶液,将其中2支试管分别加入少量二氧化锰粉末、1~2滴1mol/L的氯化铁溶液,观察产生气泡的快慢。实验现象实验结论不加任何试剂加入二氧化锰加入氯化铁溶液3.某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示。(1)下图中反应速率最快的是哪一段?对该段速率加快的原因提出合理猜想。(2)哪一段化学反应速率开始变慢?解释化学反应速率变慢的原因。活动二:通过研讨认识化学反应的限度1.组内交流可逆反应的定义、特征,并列举常见的可逆反应。2.在一定条件下,将0.05molSO2(g)和0.03molO2(g)放入容积为1L的恒容密闭容器中,发生反应2SO2(g)+O2(g)2SO3(g),待反应充分进行后,测得密闭容器内c(SO3)=0.04mol/L。(1)分别计算该条件下SO2和O2的平衡转化率。(2)通过计算你得到什么结论?【反馈评学】Ot(min)V(NO2)(mL)C·B·A·Ot(min)V(NO2)(mL)C·B·A·1.把下列4种X的溶液均加水稀释到50mL,然后分别加入4个盛有10mL2mol/L盐酸的烧杯中,此时X和盐酸缓缓地进行反应。其中反应速率最大的是A.20mL3mol/LX的溶液B.20mL2mol/LX的溶液C.10mL4mol/LX的溶液D.10mL2mol/LX的溶液2.实验室用锌粒与2mol/L硫酸制取氢气,下列措施不能增大化学反应速率的是A.用锌粉代替锌粒B.改用3mol/L硫酸溶液C.改用热的2mol/L硫酸溶液D.向该硫酸溶液中加入等体积的水3.对于工业合成氨反应:N2+3H22NH3,下列说法错误的是A.使用合适的催化剂可以增大反应速率B.升高温度可以增大反应速率C.增大N2浓度可以使H2转化率达到100℅D.增大N2浓度可以增大反应速率4.把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1~t2速率变化的主要原因是______________。t2~t3速率变化的主要原因是______________。