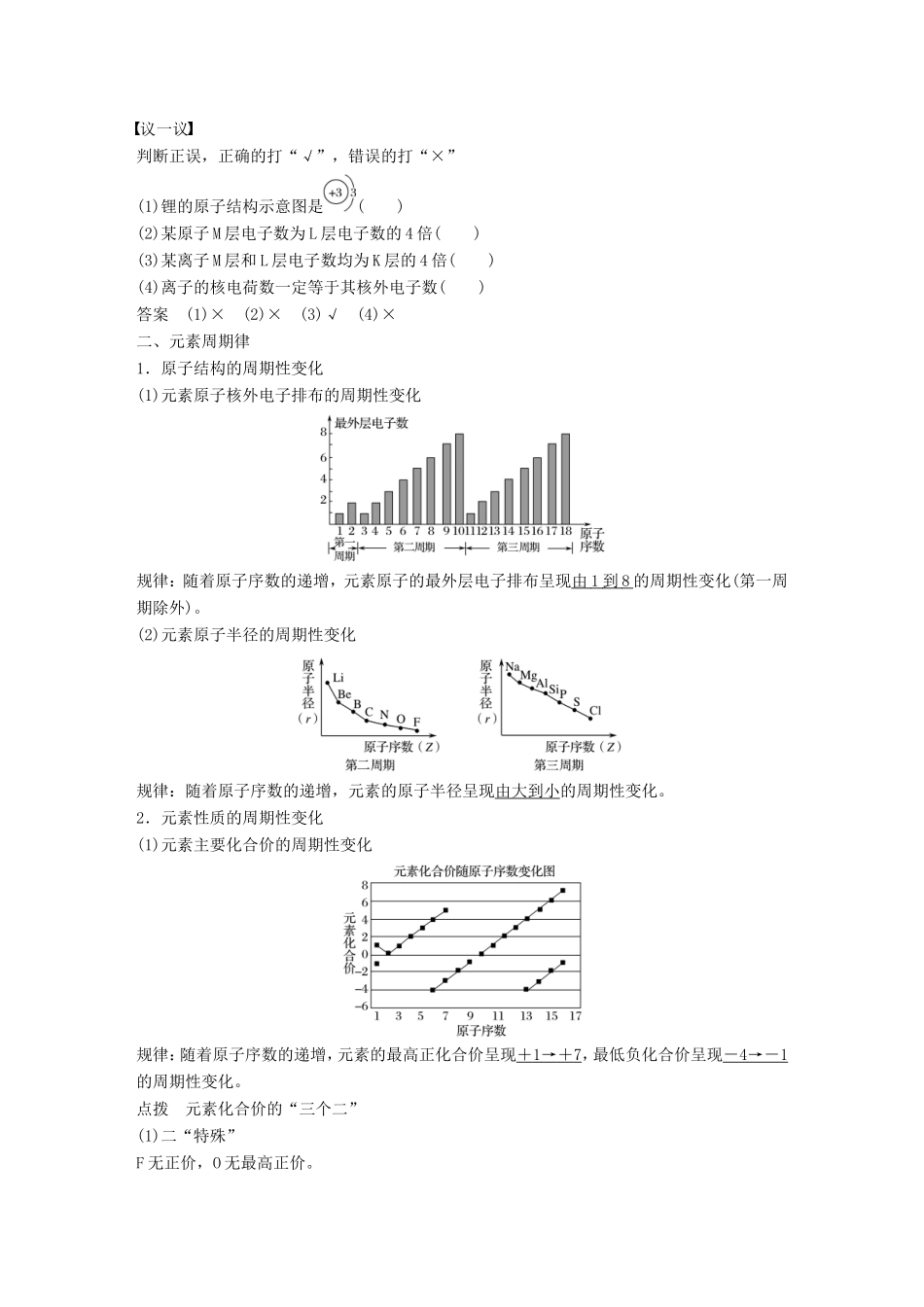
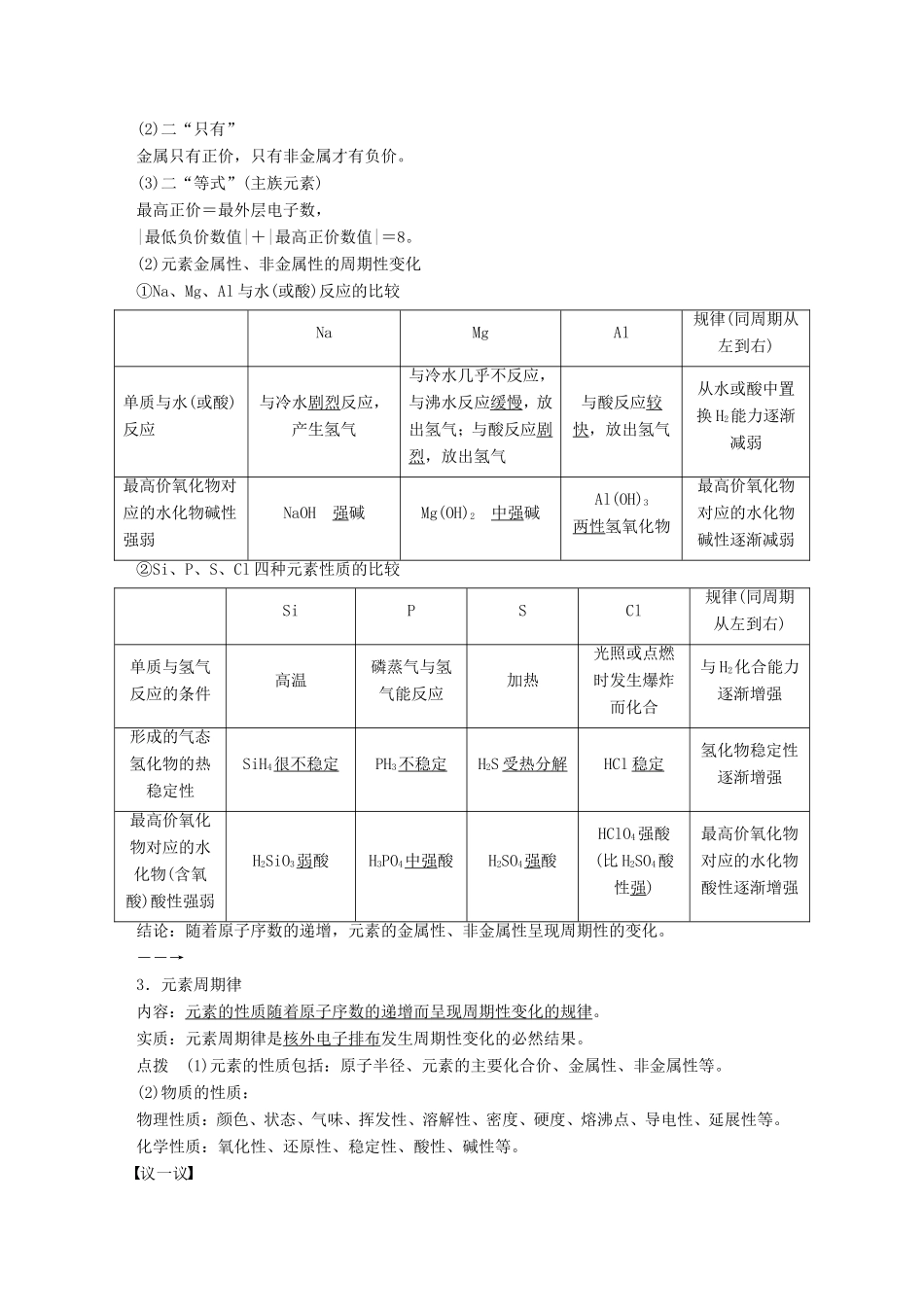
第1课时原子核外电子的排布元素周期律[目标导航]1.了解原子的核外电子能量高低与分层排布的关系。2.了解核外电子分层排布的规律。3.了解元素的原子结构和元素性质的周期性变化。4.理解元素周期律的内容和实质。一、原子核外电子的排布1.核外电子的分层排布在多电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动;能量高的,通常在离核远的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下:电子层(n)符号\s\up7(1)\s\up7(2)\s\up7(3)\s\up7(4)\s\up7(5)\s\up7(6)\s\up7(7)离核远近能量高低2.原子核外电子的排布规律3.(1)原子(离子)结构的表示方法,如下所示:(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。如:Na+;Cl-。阳离子:核外电子数小于核电荷数。阴离子:核外电子数大于核电荷数。点拨(1)电子层实质上是一个“区域”,或者说是一个“空间范围”,它与宏观上层的含义完全不同。(2)核外电子排布的规律是互相联系的,不能孤立地理解。如钙原子由于受最外层电子数不超过8个的限制。其原子结构示意图为而不应该是。议一议判断正误,正确的打“√”,错误的打“×”(1)锂的原子结构示意图是()(2)某原子M层电子数为L层电子数的4倍()(3)某离子M层和L层电子数均为K层的4倍()(4)离子的核电荷数一定等于其核外电子数()答案(1)×(2)×(3)√(4)×二、元素周期律1.原子结构的周期性变化(1)元素原子核外电子排布的周期性变化规律:随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。(2)元素原子半径的周期性变化规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。2.元素性质的周期性变化(1)元素主要化合价的周期性变化规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。点拨元素化合价的“三个二”(1)二“特殊”F无正价,O无最高正价。(2)二“只有”金属只有正价,只有非金属才有负价。(3)二“等式”(主族元素)最高正价=最外层电子数,|最低负价数值|+|最高正价数值|=8。(2)元素金属性、非金属性的周期性变化①Na、Mg、Al与水(或酸)反应的比较NaMgAl规律(同周期从左到右)单质与水(或酸)反应与冷水剧烈反应,产生氢气与冷水几乎不反应,与沸水反应缓慢,放出氢气;与酸反应剧烈,放出氢气与酸反应较快,放出氢气从水或酸中置换H2能力逐渐减弱最高价氧化物对应的水化物碱性强弱NaOH强碱Mg(OH)2中强碱Al(OH)3两性氢氧化物最高价氧化物对应的水化物碱性逐渐减弱②Si、P、S、Cl四种元素性质的比较SiPSCl规律(同周期从左到右)单质与氢气反应的条件高温磷蒸气与氢气能反应加热光照或点燃时发生爆炸而化合与H2化合能力逐渐增强形成的气态氢化物的热稳定性SiH4很不稳定PH3不稳定H2S受热分解HCl稳定氢化物稳定性逐渐增强最高价氧化物对应的水化物(含氧酸)酸性强弱H2SiO3弱酸H3PO4中强酸H2SO4强酸HClO4强酸(比H2SO4酸性强)最高价氧化物对应的水化物酸性逐渐增强结论:随着原子序数的递增,元素的金属性、非金属性呈现周期性的变化。――→3.元素周期律内容:元素的性质随着原子序数的递增而呈现周期性变化的规律。实质:元素周期律是核外电子排布发生周期性变化的必然结果。点拨(1)元素的性质包括:原子半径、元素的主要化合价、金属性、非金属性等。(2)物质的性质:物理性质:颜色、状态、气味、挥发性、溶解性、密度、硬度、熔沸点、导电性、延展性等。化学性质:氧化性、还原性、稳定性、酸性、碱性等。议一议在第三周期元素中,除稀有气体元素外:(1)原子半径最小的元素是________(填元素符号)。(2)金属性最强的元素是________(填元素符号)。(3)最高价氧化物对应水化物酸性最强的是________(用化学式回答,下同)。(4)最不稳定的气态氢化物是________。(5)最高价氧化物对应水化物碱性最强的是________。(6)氧化物中具有两性的是________。答案(1)Cl(2)Na(3)HClO4(4)SiH4(5)NaOH(6)Al2O3解析(1)第三周期元素从左到右原子半径逐渐减小,原子半径最小的是Cl。(2)金属性最强的元素在最左边,应为Na。(3)...