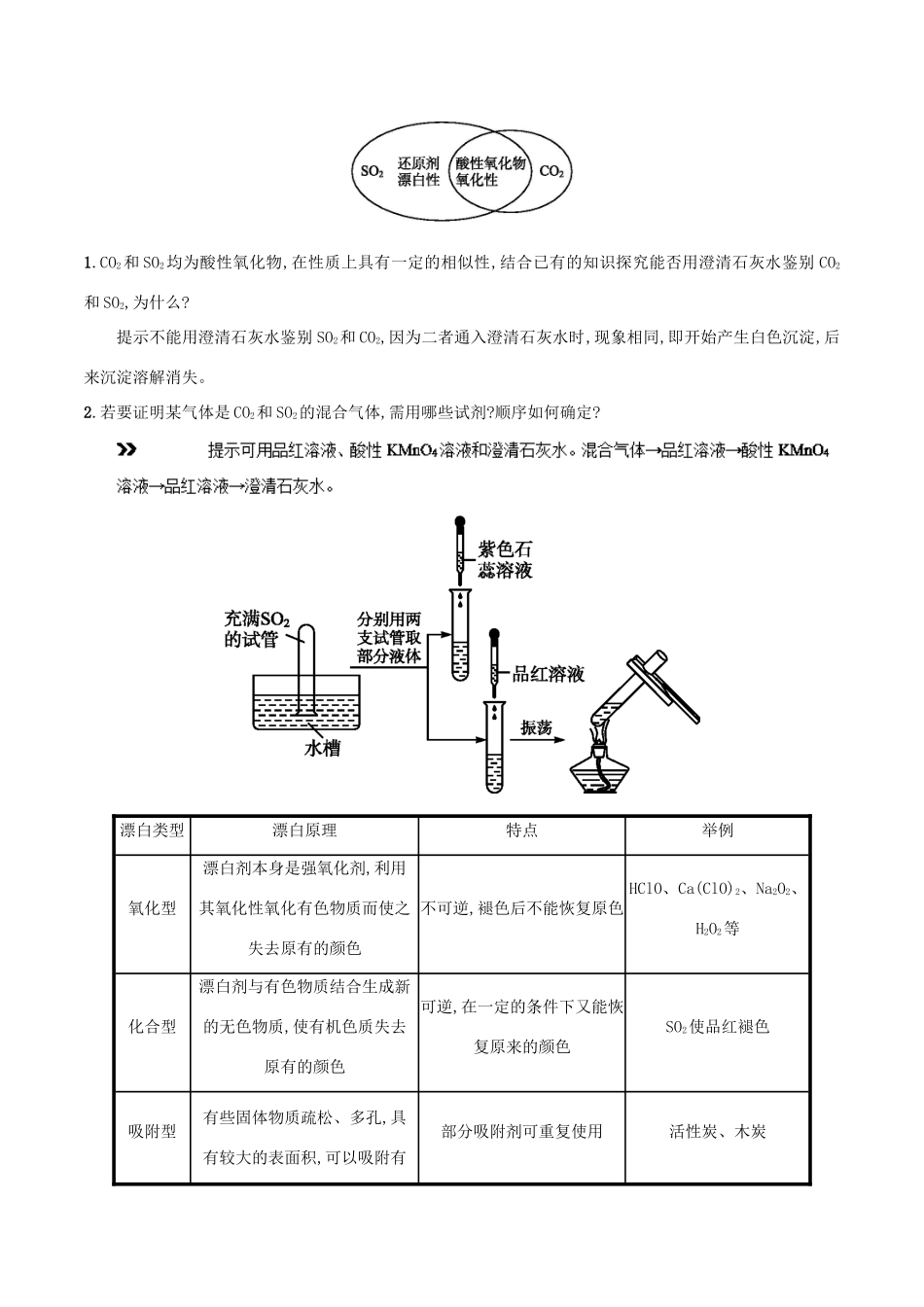
专题21硫及其氧化物【知识回放】1.请写出硫原子结构示意图。2.结合初中学习的硫单质性质,归纳总结出硫单质的物理性质。3.硫单质在空气中与纯氧中燃烧现象分别是什么?【答案】1.2.淡黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳3.空气中:淡蓝色火焰,纯氧中:蓝紫色火焰【新知精讲】一、硫(S)存在游离态存在于火山喷口或地壳的岩层里化合态主要以硫化物和硫酸盐的形式存在重要的化合物名称硫铁矿芒硝黄铜矿石膏化学式FeS2Na2SO4·10H2OCuFeS2CaSO4·2H2O物理性质颜色、状态黄色、固体溶解性不溶于水,微溶于酒精,易溶于CS2化学性质①与金属反应:与钠反应:2Na+SNa2S,与铁反应:Fe+SFeS;②与氧气反应:S+O2点燃SO2(在空气中燃烧火焰为淡蓝色,在氧气中燃烧火焰为蓝紫色)二、硫的氧化物1.二氧化硫(SO2)(1)物理性质:颜色状态气味密度溶解性无色气体刺激性气味比空气的大易溶于水(2)化学性质:①与H2O反应:SO2+H2OH2SO3。②与NaOH反应:SO2+2NaOH===Na2SO3+H2O。③与CaO反应:SO2+CaO===CaSO3。④与O2反应:2SO2+O22SO3。2.三氧化硫三氧化硫具有酸性氧化物的通性,主要反应如下:SO3【科学探究】探究一各类漂白剂的漂白原理问题导引1.分别将SO2和Cl2通入品红溶液中并加热,现象有何不同?若分别通入紫色石蕊溶液中呢?2.把SO2和Cl2同时通入溶液中,溶液的漂白性是“强强联合”吗?提示若将等物质的量的Cl2和SO2气体相混合后,在溶液中发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。探究二二氧化硫与二氧化碳的鉴别、净化及检验问题导引SO2与CO2性质的异同:1.CO2和SO2均为酸性氧化物,在性质上具有一定的相似性,结合已有的知识探究能否用澄清石灰水鉴别CO2和SO2,为什么?提示不能用澄清石灰水鉴别SO2和CO2,因为二者通入澄清石灰水时,现象相同,即开始产生白色沉淀,后来沉淀溶解消失。2.若要证明某气体是CO2和SO2的混合气体,需用哪些试剂?顺序如何确定?漂白类型漂白原理特点举例氧化型漂白剂本身是强氧化剂,利用其氧化性氧化有色物质而使之失去原有的颜色不可逆,褪色后不能恢复原色HClO、Ca(ClO)2、Na2O2、H2O2等化合型漂白剂与有色物质结合生成新的无色物质,使有机色质失去原有的颜色可逆,在一定的条件下又能恢复原来的颜色SO2使品红褪色吸附型有些固体物质疏松、多孔,具有较大的表面积,可以吸附有部分吸附剂可重复使用活性炭、木炭色物质而使之失去原有的颜色【重点突破】1.漂白原理分类特别提醒(1)漂白是有机色素失去原有颜色的过程,可能发生化学反应,如氧化型和化合型,也可能不发生化学反应,如吸附型。(2)Na2O2虽具有漂白性,但它生成的NaOH有较强的腐蚀性,所以一般不用它作漂白剂。2.SO2的漂白性(1)SO2的漂白具有选择性,可以漂白品红溶液,以及棉、麻等物品,但不能漂白酸碱指示剂,如石蕊、酚酞等。(2)SO2能使溴水、酸性KMnO4溶液褪色,是因为SO2的还原性而非漂白性。(3)利用氯水、SO2的漂白性,可以鉴别Cl2和SO2,方法是将气体分别通入品红溶液,品红溶液均褪色,然后再加热褪色后的溶液,恢复红色的通入的是SO2,不恢复原来红色的通入的是Cl2。3.SO2和CO2的性质比较SO2CO2物理性质气味有刺激性气味无味毒性有毒无毒溶解性易溶(体积比1∶40)可溶(体积比1∶1)化学性质与水的反应SO2+H2OH2SO3CO2+H2OH2CO3与碱的反应SO2气体通入澄清石灰水中,先生成沉淀,当气体过量时沉淀又溶解:Ca(OH)2+SO2===CaSO3↓+H2OCaSO3+SO2+H2O===Ca(HSO3)2CO2气体通入澄清石灰水中,先生成沉淀,当气体过量时沉淀又溶解:Ca(OH)2+CO2===CaCO3↓+H2OCaCO3+CO2+H2O===Ca(HCO3)2与碱性氧化物反应SO2+CaO===CaSO3CO2+CaO===CaCO3弱氧化性SO2+2H2S===3S↓+2H2OCO2+C2CO还原性二氧化硫能被酸性高锰酸钾溶液、氯水、溴水、碘水等氧化剂无氧化漂白性有,不稳定无对环境的影响形成酸雨引起温室效应鉴别①利用二氧化硫的还原性,能使酸性高锰酸钾溶液或溴水褪色的是二氧化硫②利用二氧化硫的漂白性,用品红溶液鉴别4.SO2和CO2鉴别方法的辨析二氧化硫和二氧化碳都能使澄清石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能用澄清石灰水来鉴别二氧化硫和二氧化碳。通常可用以下方法:(1)用品红溶液,使品红溶液褪色的是二氧化硫,不...