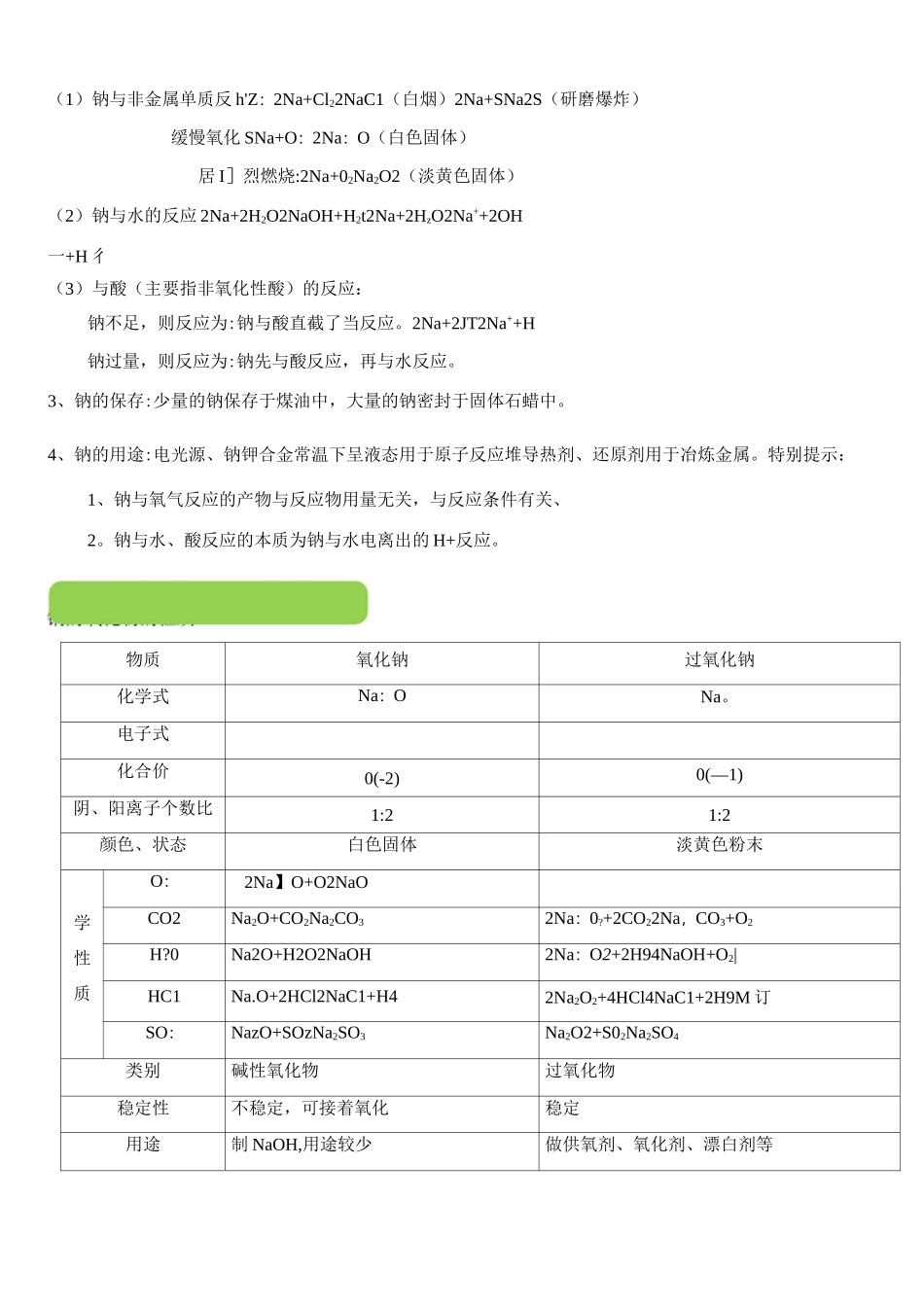
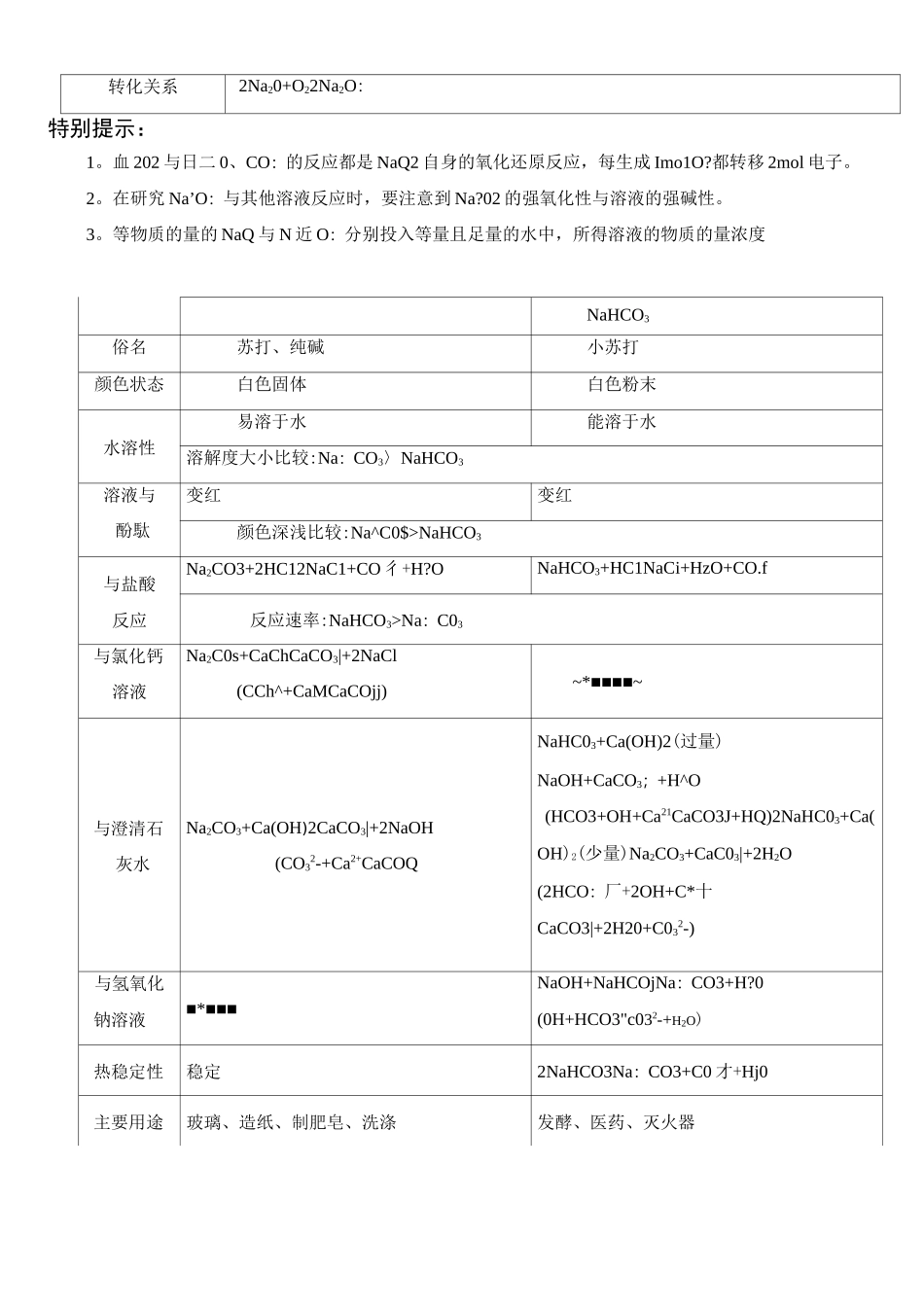
'•'•*1小07M1'一111适用区域111沪教版区域|课时时长(分钟)|2课时11知识点1、金属钠的性质2、钠的化合物的性质及用途"T1。识记有关的化学方程式;教学目标丨2。掌握金属钠及其化合物之间的转化关系;3。以金属钠为例,掌握第IA族内元素性质递变规律。教学重点[金属钠及其化合物之间的转化关系教学难点;第1人族元素性质递变规律我们明白钠元素化学在等级考的考纲中对学生有如下要求(1)掌握钠的常见物理与化学性质、(2)明白钠的常见氧化物的基本性质、(3)掌握钠化合物的性质。(4)运用简单元素周期律推断第一主族部分元素的化学性质。使用建议说明「本节课是学生理解学习纯碱工业的基础,上好这节课尤为重要;关于本节课的导入笔者认为有特别多种方法,一般控制在十分钟左右为宜,建议如下二1、直裁了当导入法I如本讲事例2、课前小测:针对学生学校里近期讲授的内容进行出题(以简单题与中档题为主,以10分钟左右为宜)进行测验,,也能够针对基础知识进行复习提问,检查学生学校所学内容的掌握程度,进而展开教学使用建议说明:钠元素化学在高考中多次出现,考纲要求掌握相关重要反应。1。物理性质:银白色金属光泽、质软、能够用刀切割、密度小于水人于煤油、熔沸点低。焰色反应为黄色。2、化学性质:教(1)钠与非金属单质反h'Z:2Na+Cl22NaC1(白烟)2Na+SNa2S(研磨爆炸)缓慢氧化SNa+O:2Na:O(白色固体)居I]烈燃烧:2Na+02Na2O2(淡黄色固体)(2)钠与水的反应2Na+2H2O2NaOH+H2t2Na+2HzO2Na++2OH一+H彳(3)与酸(主要指非氧化性酸)的反应:钠不足,则反应为:钠与酸直截了当反应。2Na+2JT2Na++H钠过量,则反应为:钠先与酸反应,再与水反应。3、钠的保存:少量的钠保存于煤油中,大量的钠密封于固体石蜡中。4、钠的用途:电光源、钠钾合金常温下呈液态用于原子反应堆导热剂、还原剂用于冶炼金属。特别提示:1、钠与氧气反应的产物与反应物用量无关,与反应条件有关、2。钠与水、酸反应的本质为钠与水电离出的H+反应。物质氧化钠过氧化钠化学式Na:ONa。电子式化合价0(-2)0(—1)阴、阳离子个数比1:21:2颜色、状态白色固体淡黄色粉末学性质O:2Na】O+O2NaOCO2Na2O+CO2Na2CO32Na:0?+2CO22Na,CO3+O2H?0Na2O+H2O2NaOH2Na:O2+2H94NaOH+O2|HC1Na.O+2HCl2NaC1+H42Na2O2+4HCl4NaC1+2H9M订SO:NazO+SOzNa2SO3Na2O2+S02Na2SO4类别碱性氧化物过氧化物稳定性不稳定,可接着氧化稳定用途制NaOH,用途较少做供氧剂、氧化剂、漂白剂等转化关系2Na20+O22Na2O:特别提示:1。血202与日二0、CO:的反应都是NaQ2自身的氧化还原反应,每生成Imo1O?都转移2mol电子。2。在研究Na’O:与其他溶液反应时,要注意到Na?02的强氧化性与溶液的强碱性。3。等物质的量的NaQ与N近O:分别投入等量且足量的水中,所得溶液的物质的量浓度NaHCO3俗名苏打、纯碱小苏打颜色状态白色固体白色粉末水溶性易溶于水能溶于水溶解度大小比较:Na:CO3〉NaHCO3溶液与酚駄变红变红颜色深浅比较:Na^C0$>NaHCO3与盐酸反应Na2CO3+2HC12NaC1+CO彳+H?ONaHCO3+HC1NaCi+HzO+CO.f反应速率:NaHCO3>Na:C03与氯化钙溶液Na2C0s+CaChCaCO3|+2NaCl(CCh^+CaMCaCOjj)~*■■■■~与澄清石灰水Na2CO3+Ca(OH)2CaCO3|+2NaOH(CO32-+Ca2+CaCOQNaHC03+Ca(OH)2(过量)NaOH+CaCO3;+H^O(HCO3+OH+Ca21CaCO3J+HQ)2NaHC03+Ca(OH)2(少量)Na2CO3+CaC03|+2H2O(2HCO:厂+2OH+C*十CaCO3|+2H20+C032-)与氢氧化钠溶液■*■■■NaOH+NaHCOjNa:CO3+H?0(0H+HCO3"c032-+H2O)热稳定性稳定2NaHCO3Na:CO3+C0才+Hj0主要用途玻璃、造纸、制肥皂、洗涤发酵、医药、灭火器相互转化Na?CO:,->NaHCO3:NazCOi+CO:+H2O2NaHCO.NaHCO:^Na2C03:NaOH+NaHCO3NaCO3+H:O(OH'+HC03~CO32-+H2O)烧时都会使火焰呈现特别的颜色,化学上叫焰色反应、2NaHC03Na2CO3+CO2f+H20鉴别1、分别加热,有气体放出者为NaHCO3(适用于固体)2、分别滴加盐酸,马上有气体放出者为NaHCCh;刚开始无气体放出,一段时间后有气体放出者为Na/COs,3、分别滴加CaCl2溶液或EaC4溶液,白色沉淀生成者为Na2CO3,NaHCO3无现彖4、等浓度溶液,碱性较强的为Na2CO3物理变化)2o焰色反应的操作顺序可概扌舌成如下几...