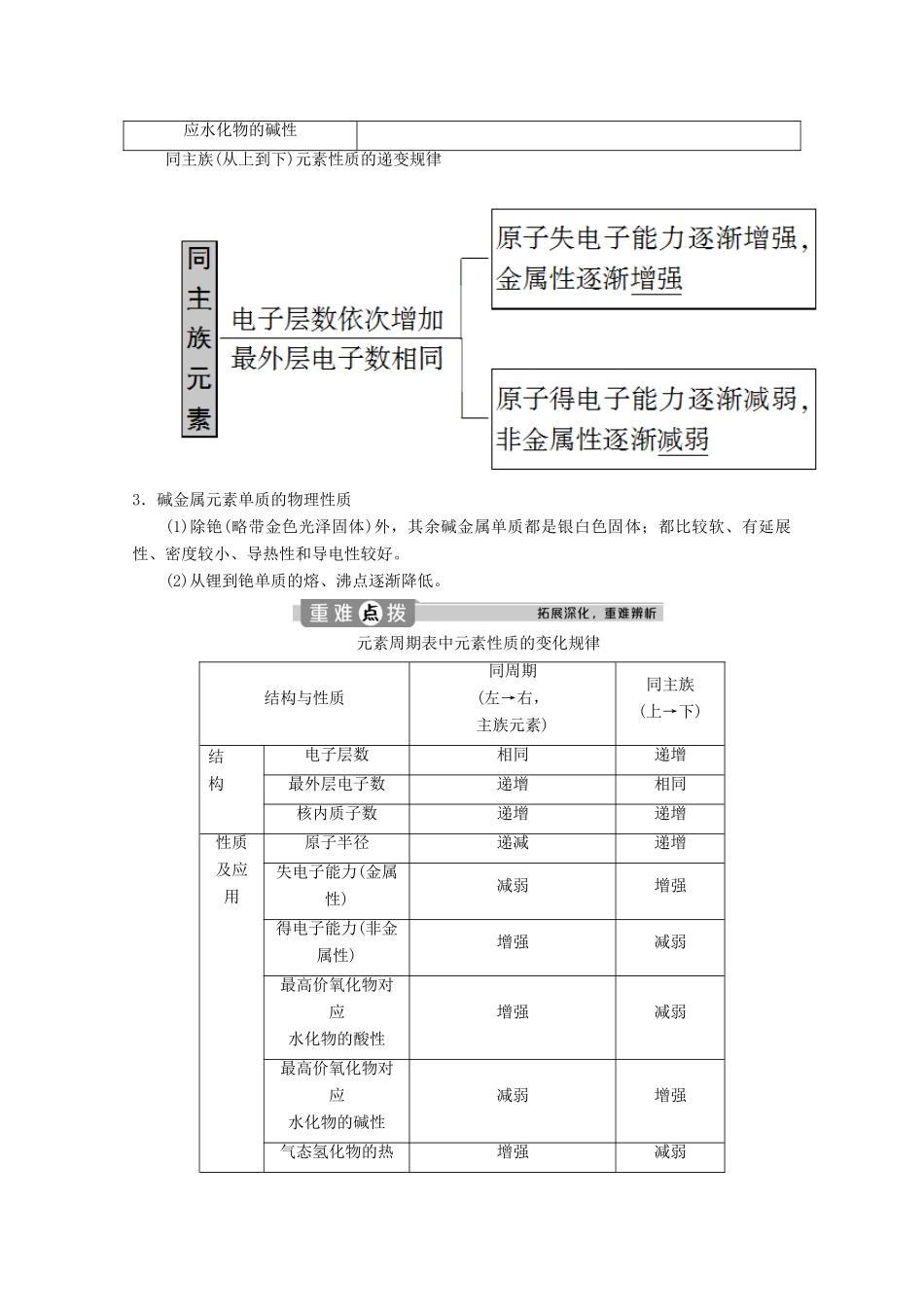
第2课时研究同主族元素的性质课程标准核心素养1.以ⅠA、ⅦA族为例,掌握同主族元素性质的递变规律。2.能运用原子结构理论初步解释同主族元素性质的递变规律。1.宏观辨识与微观探析建立原子结构、元素性质与物质性质之间的认识模型。2.证据推理与模型认知构建“位”“构”“性”关系认识模型,发展对元素及其化合物化学性质的认识模型。3.科学探究与创新意识形成实验探究元素性质递变规律、比较物质性质的思路方法,提高基于理论进行预测、提出假设的能力和基于实验事实概括、推理得出结论的能力。碱金属元素的原子结构与性质碱金属元素原子结构和性质的相似性与递变性(1)(2)递变性结构和性质递变规律原子半径――→单质的还原性――→与H2O或O2反应的剧烈程度――→最高价氧化物对――→应水化物的碱性同主族(从上到下)元素性质的递变规律3.碱金属元素单质的物理性质(1)除铯(略带金色光泽固体)外,其余碱金属单质都是银白色固体;都比较软、有延展性、密度较小、导热性和导电性较好。(2)从锂到铯单质的熔、沸点逐渐降低。元素周期表中元素性质的变化规律结构与性质同周期(左→右,主族元素)同主族(上→下)结构电子层数相同递增最外层电子数递增相同核内质子数递增递增性质及应用原子半径递减递增失电子能力(金属性)减弱增强得电子能力(非金属性)增强减弱最高价氧化物对应水化物的酸性增强减弱最高价氧化物对应水化物的碱性减弱增强气态氢化物的热增强减弱稳定性气态氢化物的还原性减弱增强铯(钫是放射性元素,不予考虑)是最活泼的金属元素;ⅠA族中碱金属元素不包括氢。1.判断正误(1)金属性:Li>Na>K>Rb。()(2)碱性:LiOH>NaOH>KOH>RbOH。()(3)稳定性:NH3>PH3,还原性:SiH4>CH4。()(4)酸性:HNO3F->Cl->S2-。()答案:(1)×(2)×(3)√(4)×(5)×2.下列关于碱金属元素的说法正确的是()①原子结构的相同点是最外层电子数相同,都为1②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大③具有相似的化学性质,都是活泼金属④都具有强还原性,在化合物中显+1价⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强A.①③④B.①③⑤C.②④⑤D.①②③④⑤解析:选D。碱金属元素原子的最外层都有1个电子,都易失去1个电子,具有强还原性,显+1价,①③④正确;从Li到Cs,原子半径逐渐增大,原子核对核外电子的束缚力逐渐减弱,失电子能力逐渐增强,②⑤正确。3.第4周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是()A.原子半径比钾的原子半径大B.氯化物难溶于水C.原子半径比镁的原子半径小D.碳酸盐难溶于水解析:选D。由最外电子层上有2个电子可知该元素为第4周期ⅡA族元素,即钙元素。结合元素周期律、元素性质的递变规律和元素化合物的性质,即可得到答案。卤族元素的原子结构与性质1.结构和性质的相似性2.结构和性质的递变性结构和性质递变规律原子半径――→单质的氧化性――→阴离子的还原性――→与H2化合的难易程度――→氢化物的稳定性――→最高价氧化物对应水化物的酸性(F除外)――→卤素单质的物理性质单质颜色状态水溶液颜色有机溶剂中的颜色熔、沸点F2淡黄绿色气体——从氟到碘,熔、沸点逐渐升高Cl2黄绿色气体浅黄绿色黄绿色Br2深红棕色液体橙黄色橙色→橙红色I2紫黑色固体深黄色→褐色深紫色→紫红色卤素单质的化学性质(1)都能与H2反应。(2)都能与大多数金属反应,如2Fe+3Br2===2FeBr3;Fe+I2=====FeI2。(3)(4)能与冷的稀碱溶液反应:X2+2NaOH===NaX+NaXO+H2O(F2、I2除外)。(5)卤素单质间的置换反应将氯水滴入溴化钠溶液:2NaBr+Cl2===2NaCl+Br2。将溴水滴入碘化钾溶液:2KI+Br2===2KBr+I2。卤族元素的特殊性氟(1)氟元素无正价,非金属性最强,F-的还原性最弱;(2)2F2+2H2O===4HF+O2,暗处即爆炸;(3)HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;(4)HF有毒;(5)在HX中HF沸点最高(HF分子间存在氢键,将在今后学到)溴(1)Br2是深红棕色液体,易挥发;(2)Br2易溶于有机溶剂;(3)保存液溴的试剂瓶中加水,进行水封,不能用橡胶塞碘(1)淀粉遇...