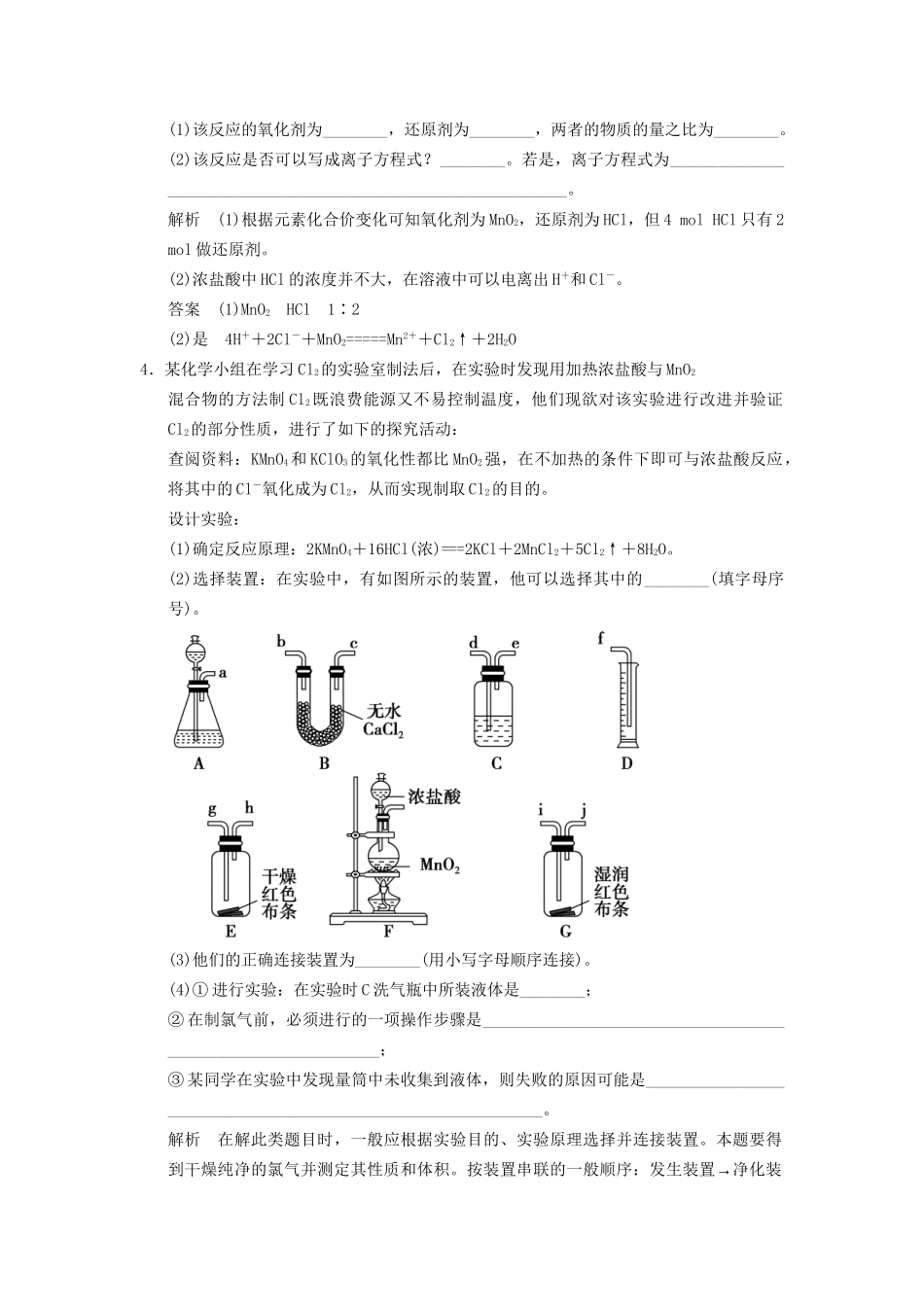
第1课时利用化学反应制备物质(时间:30分钟)考查点一氯气的实验室制备1.下列物质可用来干燥Cl2的是()。①碱石灰;②浓硫酸;③无水CaCl2;④P2O5A.①②B.①③④C.②③④D.①②③④解析因为Cl2是酸性气体,可用酸性干燥剂(②浓硫酸和④P2O5)或中性干燥剂(③无水CaCl2)干燥,不能用碱性干燥剂(①碱石灰)干燥。故C项正确。答案C2.已知KMnO4与浓HCl在常温下反应能产生Cl2。若用如图所示的实验装置制备纯净、干燥的Cl2,并观察它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是()。A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处解析KMnO4和浓HCl在常温下就可以反应生成Cl2,不需要酒精灯加热,①正确;反应产生的Cl2可能混有HCl,需要进行净化,但不能使用NaOH溶液,因为Cl2也能和NaOH溶液反应,应该使用饱和食盐水,②错误;净化后的Cl2可以用浓硫酸干燥,但气体应用长导管直接通入浓硫酸中,且出气导管应在液面以上,③错误;干燥的Cl2和金属反应的容器只有气体进入而无气体排出,一段时间后压强升高,可能会使实验装置中某处的橡皮塞弹开,④错误。答案D3.舍勒发现氯气的方法至今是实验室制取氯气的方法之一。其反应原理如下:MnO2+4HCl(浓)=====MnCl2+2H2O+Cl2↑请你分析:(1)该反应的氧化剂为________,还原剂为________,两者的物质的量之比为________。(2)该反应是否可以写成离子方程式?________。若是,离子方程式为_______________________________________________________________。解析(1)根据元素化合价变化可知氧化剂为MnO2,还原剂为HCl,但4molHCl只有2mol做还原剂。(2)浓盐酸中HCl的浓度并不大,在溶液中可以电离出H+和Cl-。答案(1)MnO2HCl1∶2(2)是4H++2Cl-+MnO2=====Mn2++Cl2↑+2H2O4.某化学小组在学习Cl2的实验室制法后,在实验时发现用加热浓盐酸与MnO2混合物的方法制Cl2既浪费能源又不易控制温度,他们现欲对该实验进行改进并验证Cl2的部分性质,进行了如下的探究活动:查阅资料:KMnO4和KClO3的氧化性都比MnO2强,在不加热的条件下即可与浓盐酸反应,将其中的Cl-氧化成为Cl2,从而实现制取Cl2的目的。设计实验:(1)确定反应原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。(2)选择装置:在实验中,有如图所示的装置,他可以选择其中的________(填字母序号)。(3)他们的正确连接装置为________(用小写字母顺序连接)。(4)①进行实验:在实验时C洗气瓶中所装液体是________;②在制氯气前,必须进行的一项操作步骤是_______________________________________________________________;③某同学在实验中发现量筒中未收集到液体,则失败的原因可能是_______________________________________________________________。解析在解此类题目时,一般应根据实验目的、实验原理选择并连接装置。本题要得→到干燥纯净的氯气并测定其性质和体积。按装置串联的一般顺序:发生装置净化装→→→置性质检验装置收集装置尾气处理装置,本题发生装置为A,净化装置为C和B,性质验证装置为E和G,气体体积测量装置为C和D。洗气瓶C的作用是除去挥发出的HCl气体,应装入饱和食盐水。在制取任何气体前,都应该先检查装置的气密性。收集不到液体的原因可能是盐酸浓度太低,反应不能进行;或者是装置漏气,产生的气体逸出;或者可能是e与f相连,故量筒中收集不到液体。答案(2)ABCDEG(3)a→d→e→b→c→g→h→i→j→e→d→f(b、c可颠倒)(4)①饱和食盐水②检查装置的气密性③装置漏气(或盐酸过稀或e与f连接)考查点二常见气体的制备5.如图所示是气体制取装置,下列能用此装置制取气体并能“”随开随用、随关随停的是()。A.大理石和稀硫酸制取二氧化碳B.锌粒和稀硫酸制氢气C.浓盐酸和二氧化锰制氯气D.电石和水制取乙炔解析根据题中所给装置特点,制取气体的反应应该具备以下特点:①反应不需加热,②反应不能太剧烈,因此C、D选项不合理,又因硫酸钙微溶于水,故生成的CaSO4附着于大理石表面时,可能阻止反应进行,故A不符合,选B。答案B6.按下述实验方法制备气体,合理又实用的是()。A.锌粒与稀H2SO4反应制备H2B.用稀HCl溶液和M...