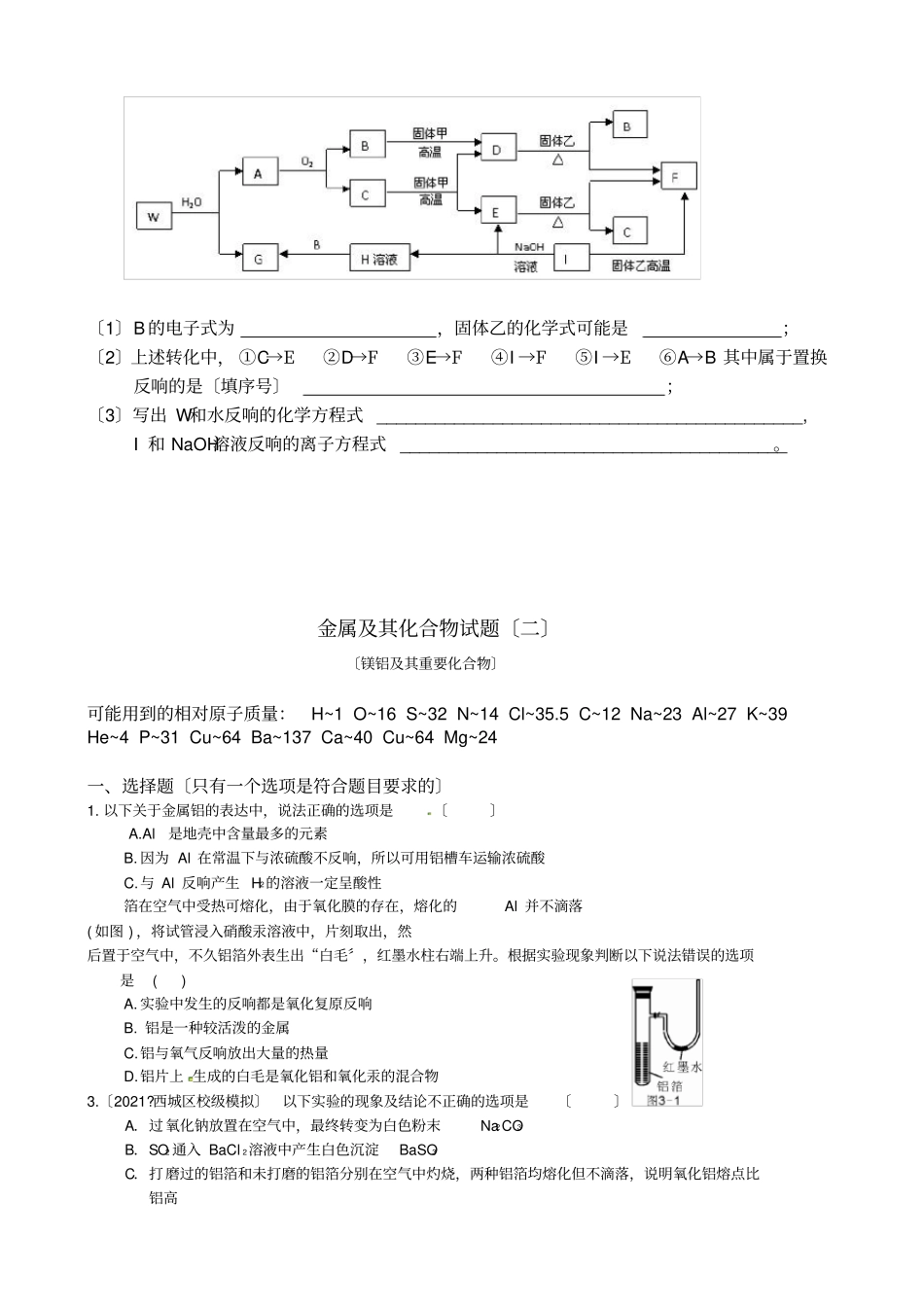
金属及其化合物试题〔一〕1.所谓合金,就是不同种金属〔也包括一些非金属〕在熔化状态下形成的一种熔合物,根据以下四种金属的熔沸点:NaCuAlFe熔点〔0C〕10836601535沸点〔0C〕883259522003000你判断其中不能形成合金的是()A.Cu和AlB.Fe和CuC.Fe和NaD.Al和Na2.“混盐〞是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐〞是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,以下各化合物中属于混盐的是()A.CaOCl2B.〔NH4〕2Fe(SO4)2C.BiONO3D.K3[Fe(CN)6]3.以下进展性质比拟的实验,不合理的是〔〕A.比拟Cu、Fe2+的复原性:铁参加硫酸铜溶液中B.比拟氯、溴单质的氧化性:溴化钠溶液中通入氯气C.比拟镁、铝金属性:氯化镁、氯化铝溶液中分别参加过量的NaOH溶液D.比拟碳、硫非金属性:测定同条件同物质的量浓度的Na2CO3、Na2SO4溶液的pH4.关于金属元素在自然界存在的情况的表达中,正确的选项是〔〕(双选)A.金属元素仅存在于矿物中。B.金属元素存在于矿物和动物体內,但植物体內不含。C.少数金属元素以游离态存在,大多数金属元素以化合态存在。D.金属元素不仅存在矿物中,动物和植物体內也存在少量金属元素5.〔2021?福建〕以下物质与水作用形成的溶液能与NH4Cl反响生成NH3的是〔〕A.二氧化氮B.钠C.硫酸镁D.二氧化硅6.将少量金属钠分别投入以下物质的水溶液中,有气体放出,且溶液质量减轻的是〔〕A.HCB.NaOHC.K2SO4D.MgSO47.以下反响中,反响后固体物质增重的是〔〕A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反响D.将锌粒投入Cu(NO3)2溶液8..Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反响以下说法中正确的选项是()2O2只作氧化剂2FeO4既是氧化产物又是复原产物2是复原产物D.2molFeSO4发生反响时,反响中共有8mol电子转移9.以下类比关系正确的选项是()A.AlCl3与过量NaOH溶液反响生成2AlO,那么与过量NH3·H2O也生成2AlOB.Na2O2与CO2反响生成Na2CO3和O2,那么与SO2反响可生成Na2SO3和O2C.Fe与Cl2反响生成FeCl3,那么与I2反响可生成FeI3D.Al与Fe2O3能发生铝热反响,那么与MnO2也能发生铝热反响10.常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mLc〔OH﹣〕=0.1mol/L的溶液,然后逐滴参加1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如下图,那么以下说法正确的选项是〔〕A.原合金质量为0.92gB.图中V2为100C.整个参加盐酸过程中Na+的浓度保持不变D.Q点m111.自然界中存在一种尖晶石,化学式可表示为MgAl2O4,它透明色美,可作为宝石。该尖晶石中混有Fe2O3。取一定量样品,恰好完全溶解在一定浓度100mL盐酸溶液中,盐酸浓度可能是〔〕A.2.8mol·L-1B.3.8mol·L-1C.4.3mol·L-1D.4.9mol·L-112.铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中铝的含量超过国家标准就会对人体造成危害。以下关于铝元素的说法正确的选项是〔〕A.铝在空气中不易氧化是因为性质不活泼B.氢氧化铝可与胃酸反响,常用作中和胃酸的药物C.明矾可用于饮用水的杀菌消毒D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水13.将铝、铁物质的量均为0.2mol的某种铝铁合金粉末分别于以下溶液充分反响〔溶液均过量〕,放出氢气最多的是〔〕A.18.4mol?L﹣1H2SO4溶液B.1.5mol?L﹣1HCl溶液C.4mol?L﹣1HNO3溶液D.3mol?L﹣1NaOH溶液均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反响时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反响生成A和G时的化学计量数之比为1:3:3:1。各物质有如以下图所示的转化关系〔局部反响的产物未全部表示〕。试答复以下题:〔1〕B的电子式为,固体乙的化学式可能是;〔2〕上述转化中,①C→E②D→F③E→F④I→F⑤I→E⑥A→B其中属于置换反响的是〔填序号〕;〔3〕写出W和水反响的化学方程式_____________________________...