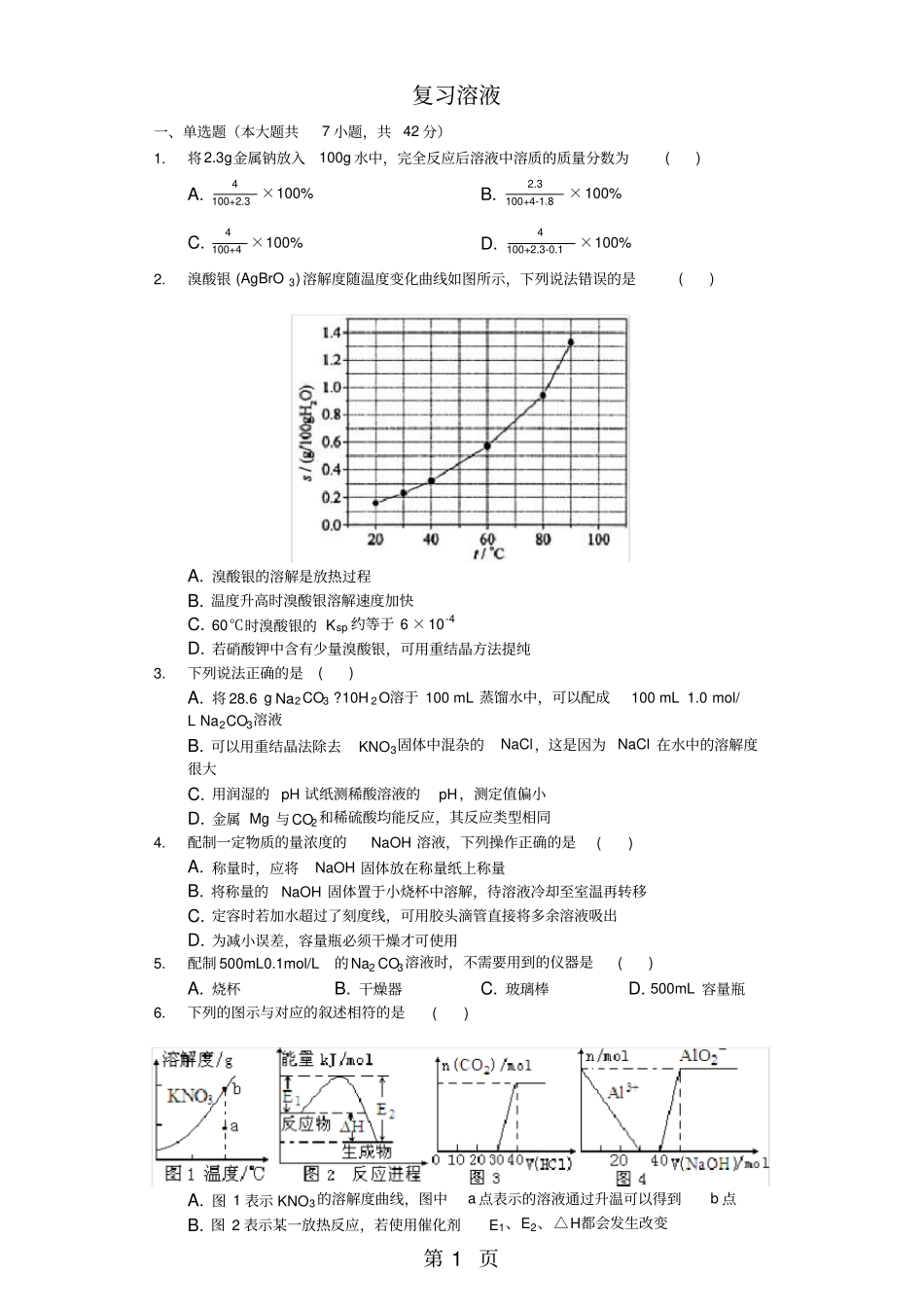
第1页复习溶液一、单选题(本大题共7小题,共42分)1.将2.3g金属钠放入100g水中,完全反应后溶液中溶质的质量分数为()A.4100+2.3×100%B.2.3100+4-1.8×100%C.4100+4×100%D.4100+2.3-0.1×100%2.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是()A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.60℃时溴酸银的Ksp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯3.下列说法正确的是()A.将28.6gNa2CO3?10H2O溶于100mL蒸馏水中,可以配成100mL1.0mol/LNa2CO3溶液B.可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大C.用润湿的pH试纸测稀酸溶液的pH,测定值偏小D.金属Mg与CO2和稀硫酸均能反应,其反应类型相同4.配制一定物质的量浓度的NaOH溶液,下列操作正确的是()A.称量时,应将NaOH固体放在称量纸上称量B.将称量的NaOH固体置于小烧杯中溶解,待溶液冷却至室温再转移C.定容时若加水超过了刻度线,可用胶头滴管直接将多余溶液吸出D.为减小误差,容量瓶必须干燥才可使用5.配制500mL0.1mol/L的Na2CO3溶液时,不需要用到的仪器是()A.烧杯B.干燥器C.玻璃棒D.500mL容量瓶6.下列的图示与对应的叙述相符的是()A.图1表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点B.图2表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变C.图3表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况D.图4表示向100mL0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况7.配制100mL1mol/LNaOH溶液必须的仪器是()A.量筒B.试管C.容量瓶D.分液漏斗二、实验题(本大题共1小题,共14分)8.实验室需要0.1mol?L-1NaOH溶液450mL和0.5mol?L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).(2)下列操作中,容量瓶所不具备的功能有______(填序号).A.配制一定体积准确浓度的标准溶液B.贮存溶液C.测量容量瓶规格以下的任意体积的液体D.准确稀释某一浓度的溶液E.用来加热溶解固体溶质(3)根据计算用托盘天平称取NaOH的质量为2.0g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol?L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度______0.1mol?L-1.(4)根据计算得知,所需质量分数为98%、密度为1.84g?cm-3的浓硫酸的体积为______mL(计算结果保留一位小数).配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______.三、简答题(本大题共4小题,共44分)9.实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.(1)在如图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.(2)在容量瓶的使用方法中,下列操作不正确的是______.A.使用容量瓶前检验是否漏水B.容量瓶用水洗净后,再用待配溶液洗涤C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线.D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线.E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.(3)根据计算用托盘天平称取的质量为______g.(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.(5)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)第3页①浓硫酸溶解后未冷至室温即进行定容______;②定容时俯视刻度线______.10.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.现用该浓硫酸配制980mL0.1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒...