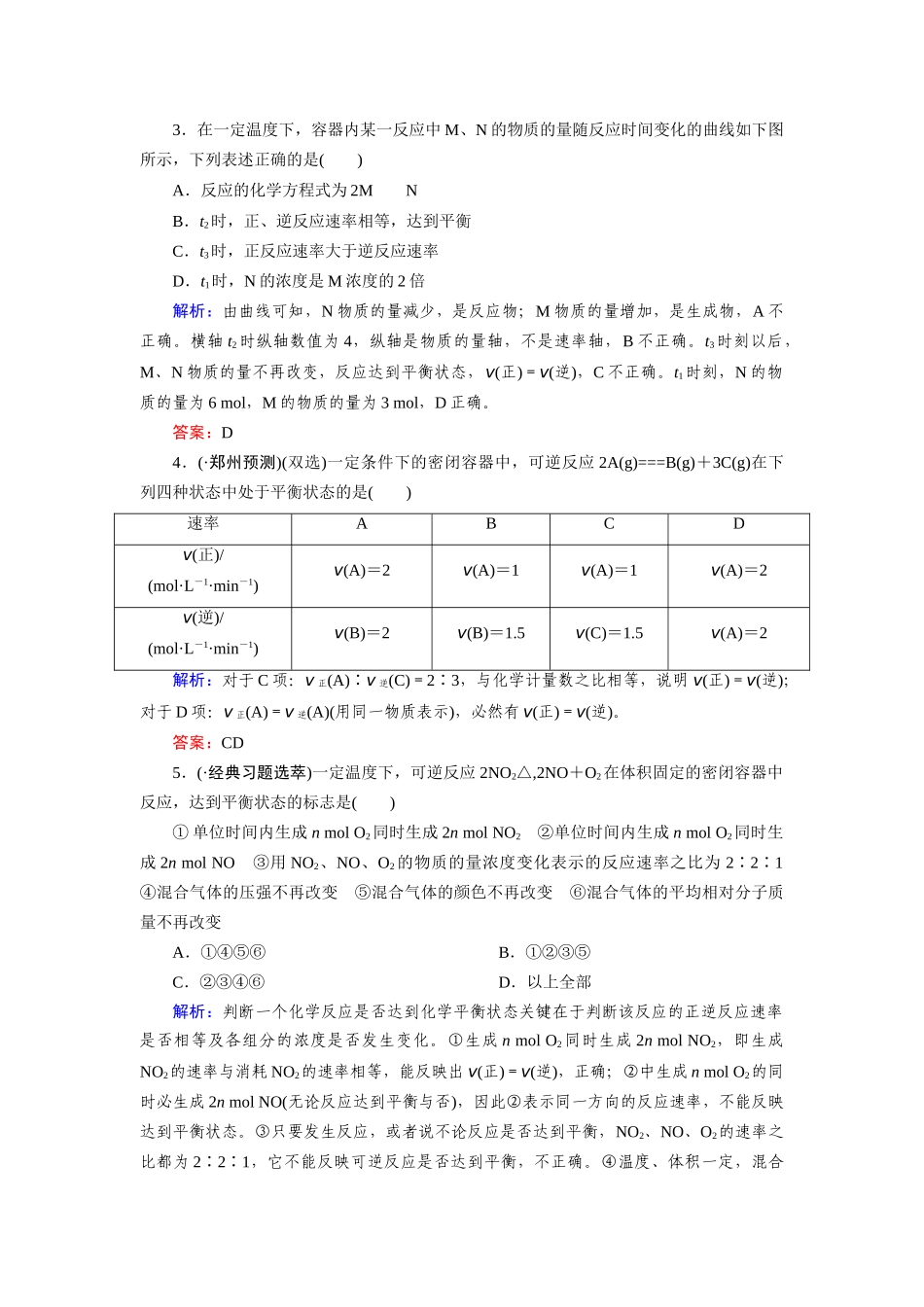
【成才之路】-学年高中化学2-3-1化学平衡状态课时达标作业新人教版选修4一、选择题1.下列反应中,属于可逆反应的是()①N2+3H2=====2NH3,2NH3=====3H2+N2②2NaHCO3△,Na2CO3+H2↑+CO2↑,Na2CO3+H2O+CO2,2NaHCO3③CH3CH2OH――→CH2===CH2↑+H2O,CH2===CH2+H—OH――→CH3CH2OH④2Na+Cl2点燃,2NaCl,2NaCl电解,2Na+Cl2A.只有①B.①②③C.①②③④D.①③④解析:可逆反应是指在同一条件下既向正反应方向进行又向逆反应方向进行的反应,符合此条件的只有①。答案:A2.(·济南1月调研)反应C(s)+H2O(g)===CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是()A.其他条件不变仅将容器的体积缩小一半,反应速率减小B.反应达平衡状态时:v(CO)正=v(H2O)逆C.保持体积不变,充入少量He使体系压强增大反应速率一定增大D.其他条件不变,适当增加C(s)的质量会使反应速率增大解析:本题考查影响反应速率的因素,考查考生运用影响反应速率的因素分析问题的能力。难度中等。A项,将容器的容积缩小一半相当于体系压强增加一倍,反应速率加快;B项,转化为同一物质的速率,其正、逆反应速率相等,处于平衡状态;C项,由于体积保持不变,充入He气后,各组分的浓度不变,反应速率不变;D项,改变固体物质的用量不影响化学反应速率。答案:B3.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述正确的是()A.反应的化学方程式为2MNB.t2时,正、逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍解析:由曲线可知,N物质的量减少,是反应物;M物质的量增加,是生成物,A不正确。横轴t2时纵轴数值为4,纵轴是物质的量轴,不是速率轴,B不正确。t3时刻以后,M、N物质的量不再改变,反应达到平衡状态,v(正)=v(逆),C不正确。t1时刻,N的物质的量为6mol,M的物质的量为3mol,D正确。答案:D4.(·郑州预测)(双选)一定条件下的密闭容器中,可逆反应2A(g)===B(g)+3C(g)在下列四种状态中处于平衡状态的是()速率ABCDv(正)/(mol·L-1·min-1)v(A)=2v(A)=1v(A)=1v(A)=2v(逆)/(mol·L-1·min-1)v(B)=2v(B)=1.5v(C)=1.5v(A)=2解析:对于C项:v正(A)∶v逆(C)=2∶3,与化学计量数之比相等,说明v(正)=v(逆);对于D项:v正(A)=v逆(A)(用同一物质表示),必然有v(正)=v(逆)。答案:CD5.(·经典习题选萃)一定温度下,可逆反应2NO2△,2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是()①单位时间内生成nmolO2同时生成2nmolNO2②单位时间内生成nmolO2同时生成2nmolNO③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1④混合气体的压强不再改变⑤混合气体的颜色不再改变⑥混合气体的平均相对分子质量不再改变A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部解析:判断一个化学反应是否达到化学平衡状态关键在于判断该反应的正逆反应速率是否相等及各组分的浓度是否发生变化。①生成nmolO2同时生成2nmolNO2,即生成NO2的速率与消耗NO2的速率相等,能反映出v(正)=v(逆),正确;②中生成nmolO2的同时必生成2nmolNO(无论反应达到平衡与否),因此②表示同一方向的反应速率,不能反映达到平衡状态。③只要发生反应,或者说不论反应是否达到平衡,NO2、NO、O2的速率之比都为2∶2∶1,它不能反映可逆反应是否达到平衡,不正确。④温度、体积一定,混合气体压强不再改变,说明气体的总物质的量不变,表明反应已达到平衡状态。⑤颜色的深浅决定于有色物质NO2的浓度,混合物气体颜色不变,说明NO2浓度不再改变,对固定容器来说,NO2的物质的量不再变化,能说明反应已达到平衡状态,正确。⑥混合气体的平均相对分子质量不变,说明气体的总物质的量(n)不变,表明反应已达到平衡状态,正确。答案:A6.(双选)下列说法可以证明反应N2(g)+3H2(g)2NH3(g),已达平衡状态的是()A.1个N≡N键断裂的同时,有3个H—H键形成B.1个N≡N键断裂的同时,有3个H—H键断裂C.1个N≡N键断裂的同时,有6个N—H键断裂D.1个N≡N键断裂的同时,有6个N—H键形成解析:1个N≡N键断裂为正...