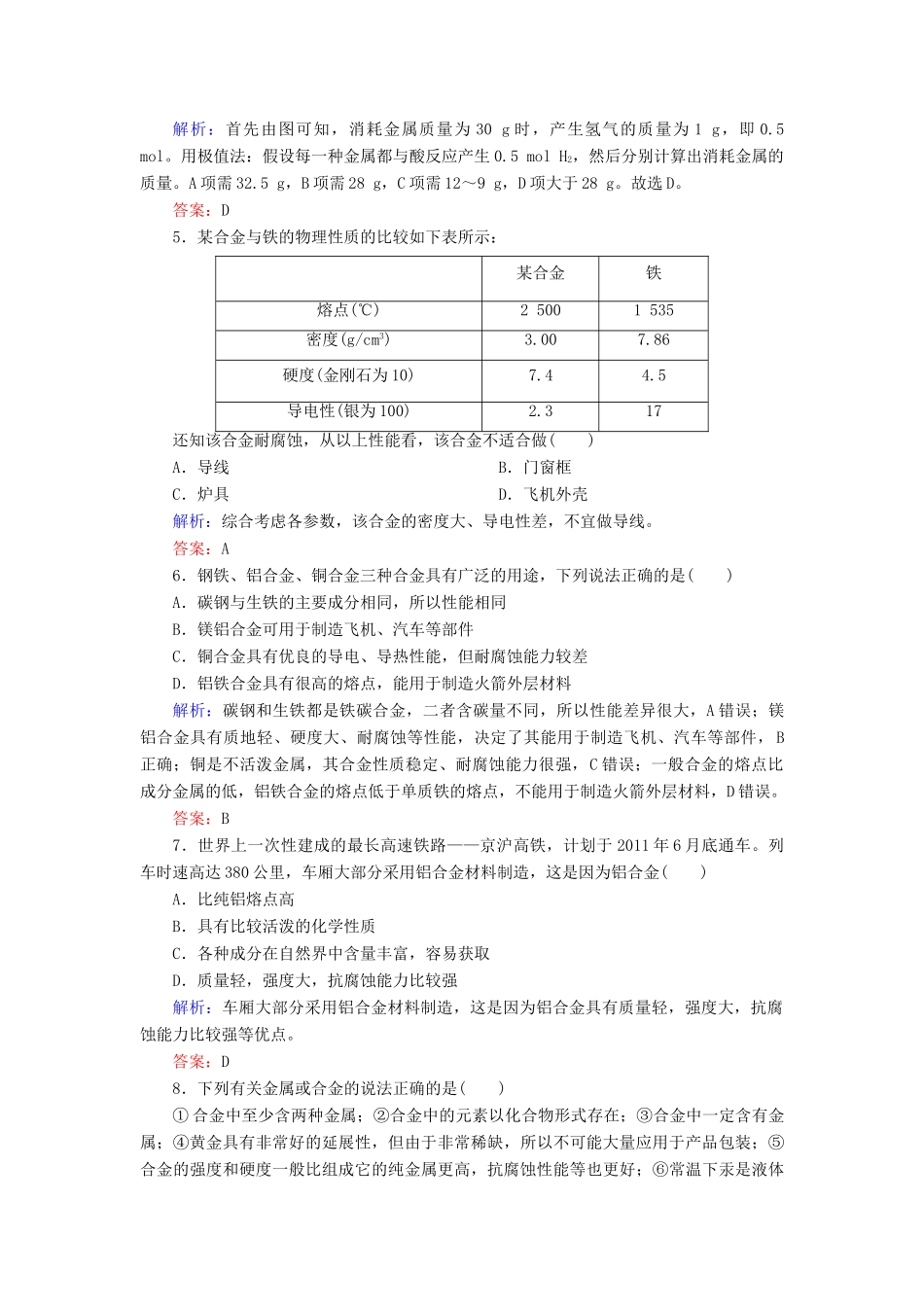
3.3用途广泛的金属材料课时作业\s\up7(时间:45分钟满分:100分)一、选择题(每小题4分,共48分)1.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑、装潢材料,主要用于制作窗框、卷帘门、防护栏等,下列与这些用途无关的性质是()A.不易生锈B.导电导热性好C.密度小D.强度高解析:题目中所提到的用途与导电导热性无关。镁铝合金具有性质稳定、质地轻,硬度大等特点,且外观漂亮,适合于作装潢材料,而金属的导电性用于制作电线电缆。答案:B2.合金在推动人类文明中起到了重要的作用。下列说法正确的是()A.战国时期的青铜器由铜锌合金铸造而成B.所有合金材料都具有较强的抗腐蚀能力C.生铁的硬度大于钢的硬度,常用于锻造各种零件D.改变原料的配比、改变生成合金的条件,可得到有不同性能的合金解析:铜锌合金是黄铜,青铜一般是铜锡合金,A错误;不锈钢等合金具有较强的抗腐蚀能力,但有些合金的抗腐蚀能力弱,如碳素钢,B错误;生铁硬度大、抗压、性脆,可用于铸造,但不能用于锻造,C错误;合金配比不同其性能不同,D正确。答案:D3.现代建筑的门窗框架常用电镀加工成的古铜色硬铝制造。取硬铝样品进行如下图所示的实验(每一步试剂均过量),由此可推知,硬铝的组成为()样品――→A.Al,Cu,Mg,SiB.Al,Mg,Si,ZnC.Al,Fe,C,CuD.Al,Si,Zn,Na解析:根据硬铝样品反应图示,硬铝中存在与稀盐酸反应的成分(Al,Mg),反应不溶物能与NaOH溶液反应生成H2(Si),还有不溶物(Cu)。答案:A4.某金属与盐酸反应时,生成H2的质量与消耗金属质量的关系如下图所示,此金属可能是()A.纯锌B.纯铁C.镁铝合金D.铜铁合金解析:首先由图可知,消耗金属质量为30g时,产生氢气的质量为1g,即0.5mol。用极值法:假设每一种金属都与酸反应产生0.5molH2,然后分别计算出消耗金属的质量。A项需32.5g,B项需28g,C项需12~9g,D项大于28g。故选D。答案:D5.某合金与铁的物理性质的比较如下表所示:某合金铁熔点(℃)25001535密度(g/cm3)3.007.86硬度(金刚石为10)7.44.5导电性(银为100)2.317还知该合金耐腐蚀,从以上性能看,该合金不适合做()A.导线B.门窗框C.炉具D.飞机外壳解析:综合考虑各参数,该合金的密度大、导电性差,不宜做导线。答案:A6.钢铁、铝合金、铜合金三种合金具有广泛的用途,下列说法正确的是()A.碳钢与生铁的主要成分相同,所以性能相同B.镁铝合金可用于制造飞机、汽车等部件C.铜合金具有优良的导电、导热性能,但耐腐蚀能力较差D.铝铁合金具有很高的熔点,能用于制造火箭外层材料解析:碳钢和生铁都是铁碳合金,二者含碳量不同,所以性能差异很大,A错误;镁铝合金具有质地轻、硬度大、耐腐蚀等性能,决定了其能用于制造飞机、汽车等部件,B正确;铜是不活泼金属,其合金性质稳定、耐腐蚀能力很强,C错误;一般合金的熔点比成分金属的低,铝铁合金的熔点低于单质铁的熔点,不能用于制造火箭外层材料,D错误。答案:B7.世界上一次性建成的最长高速铁路——京沪高铁,计划于2011年6月底通车。列车时速高达380公里,车厢大部分采用铝合金材料制造,这是因为铝合金()A.比纯铝熔点高B.具有比较活泼的化学性质C.各种成分在自然界中含量丰富,容易获取D.质量轻,强度大,抗腐蚀能力比较强解析:车厢大部分采用铝合金材料制造,这是因为铝合金具有质量轻,强度大,抗腐蚀能力比较强等优点。答案:D8.下列有关金属或合金的说法正确的是()①合金中至少含两种金属;②合金中的元素以化合物形式存在;③合金中一定含有金属;④黄金具有非常好的延展性,但由于非常稀缺,所以不可能大量应用于产品包装;⑤合金的强度和硬度一般比组成它的纯金属更高,抗腐蚀性能等也更好;⑥常温下汞是液体所以汞应该属于非金属。A.①②③⑤B.①②④⑥C.①③④⑤D.③④⑤解析:对合金概念的理解,应注意以下几点:合金是金属与金属(或非金属)熔合形成的,所以一定是混合物;合金中至少含有一种金属,同时也可能含有非金属;合金具有金属通性,且合金有许多优良的性能,在某些方面优于纯金属。由于黄金非常稀缺,故不可能大量应用于产品包装;常温下汞虽然为液体...