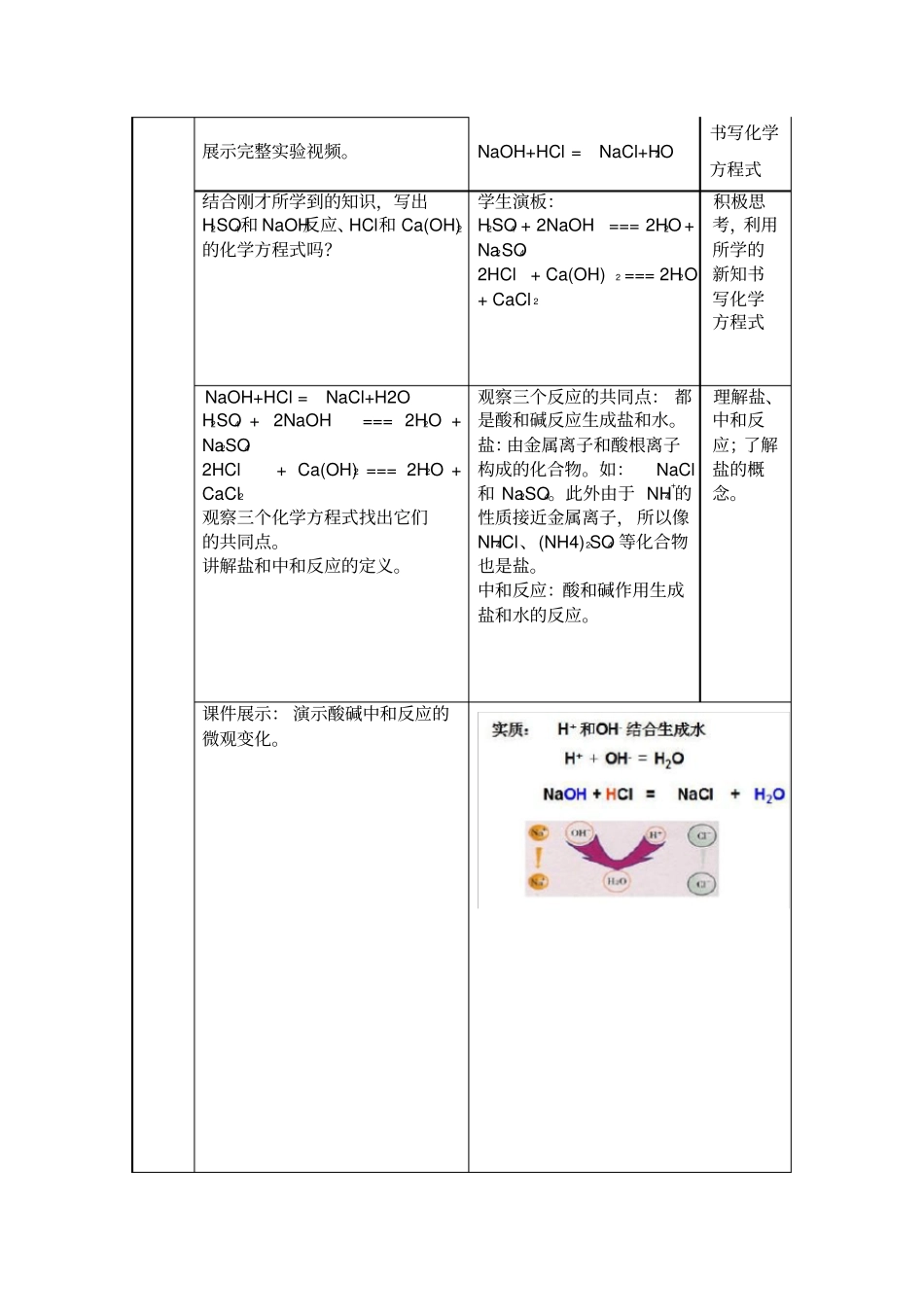
酸和碱的中和反应教学设计一、教学目标(一)知识与技能1.知道酸和碱之间发生中和反应,初步领会中和反应的实质。2.了解中和反应在实际中的应用。(二)过程与方法1.通过验证酸碱之间的反应,认识科学探究的基本过程,进行初步的探究活动。2.通过展示中和反应实质的微观图片,建立宏观现象与微观实质的联系。(三)情感态度与价值观1.进一步增强探究物质的好奇心和求知欲。2.体会化学与生活的密切关系,增强热爱生活、关心他人的美好情感。二、教学重、难点重点:中和反应的判断和应用。难点:对中和反应实质的认识。三、教学方法实验探究、多媒体教学四、教学过程教学环节教师活动学生活动设计意图新课引入化学世界是一个五彩斑斓的世界也是一个充满魔幻的世界,为了展现化学的无穷魅力,我先个同学们展示一个小魔术。学生仔细观察老师的魔术。激发学生兴趣让学生大胆猜想。新课讲授提出问题:我们已经学习了酸和碱两类不同的化合物,如果把它们两者的溶液混合会不会反应呢?活动与探究:①取一支试管加入适量氢氧化钠溶液。②试管中滴加盐酸溶液。③同学们一起观察现象,分析原因。引导:我们知道酸溶液、碱溶液均能使酸碱指示剂变色,如果我们在氢氧化钠溶液中先滴加几滴无色酚酞溶液,继续上述实验,又会出现怎样的结果呢?利用酸和碱都能与指示剂作用使指示剂变色,学生先设计方案。学生上讲台演示:①取一支试管,加入适量氢氧化钠溶液。②用滴管向试管中滴加两滴酚酞试液,观察现象。③再向试管中滴加盐酸溶液,观察现象,分析原因。在探究过程中培养学生的思维能力和实验能力讨论:①酚酞在实验中起什么作用?②为什么在操作中必须逐滴滴入稀盐酸?学生回答问题并认真听老师分析。酚酞起起指示作用,因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。逐滴滴加防止稀盐酸滴加过量。注意:滴加盐酸至红色恰好变成无色时即止,否则盐酸过量。实验完毕,进行交流实验方案和现象。展示完整实验视频。NaOH+HCl=NaCl+H2O书写化学方程式结合刚才所学到的知识,写出H2SO4和NaOH反应、HCl和Ca(OH)2的化学方程式吗?学生演板:H2SO4+2NaOH===2H2O+Na2SO42HCl+Ca(OH)2===2H2O+CaCl2积极思考,利用所学的新知书写化学方程式NaOH+HCl=NaCl+H2OH2SO4+2NaOH===2H2O+Na2SO42HCl+Ca(OH)2===2H2O+CaCl2观察三个化学方程式找出它们的共同点。讲解盐和中和反应的定义。观察三个反应的共同点:都是酸和碱反应生成盐和水。盐:由金属离子和酸根离子构成的化合物。如:NaCl和Na2SO4。此外由于NH4+的性质接近金属离子,所以像NH4Cl、(NH4)2SO4等化合物也是盐。中和反应:酸和碱作用生成盐和水的反应。理解盐、中和反应;了解盐的概念。课件展示:演示酸碱中和反应的微观变化。中和反应在实际生活中的应用课件展示:改良土壤的酸碱性处理工厂的废水用于医药①感受生活中处处有化学,生活离不开化学。②进一步理解中和反应。③书写有关化学方程式。①1、巩固所学的知识。②应用所学知识解决现实生活中的问题。课堂小结1.盐的定义。2.中和反应:酸碱作用生成盐和水的反应。3.中和反应的实质以及中和反应在实际中的应用。课堂练习1、下列反应属于中和反应的是()A.2HCl+CuO=CuCl2+H2OB.2NaOH+CO2=NaCO3+H2OC.2HCl+Ca(OH)2=CaCl2+H2OD.CaCO3+2HCl=CaCl2+H2O+CO2↑2.下列各组物质中,要借助指示剂才能判断反应发生的是()A.碳酸钙和稀盐酸B.氢氧化钡和硫酸C.氢氧化钠和稀盐酸D.氢氧化铁和稀盐酸3.鱼胆弄破后会使鱼肉沾上难溶于水的胆汁酸而变苦,要减少这种苦味,用来洗涤的最佳物质是()A.水B.纯碱C.食盐D.食醋4.下列属于盐的是()A.HNO3B.Mg(OH)2C.Na2CO3D.FeO课外科普小知识