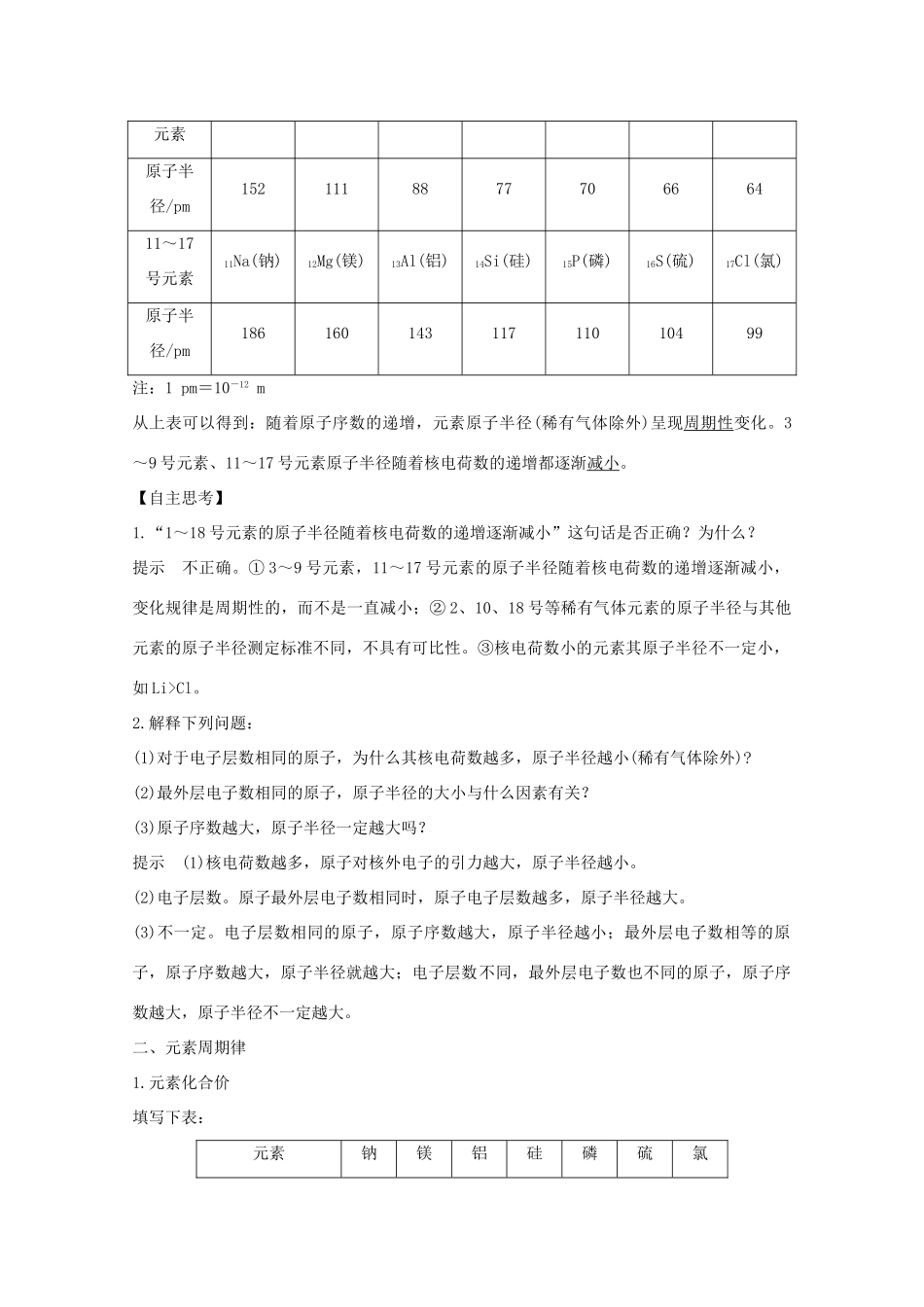
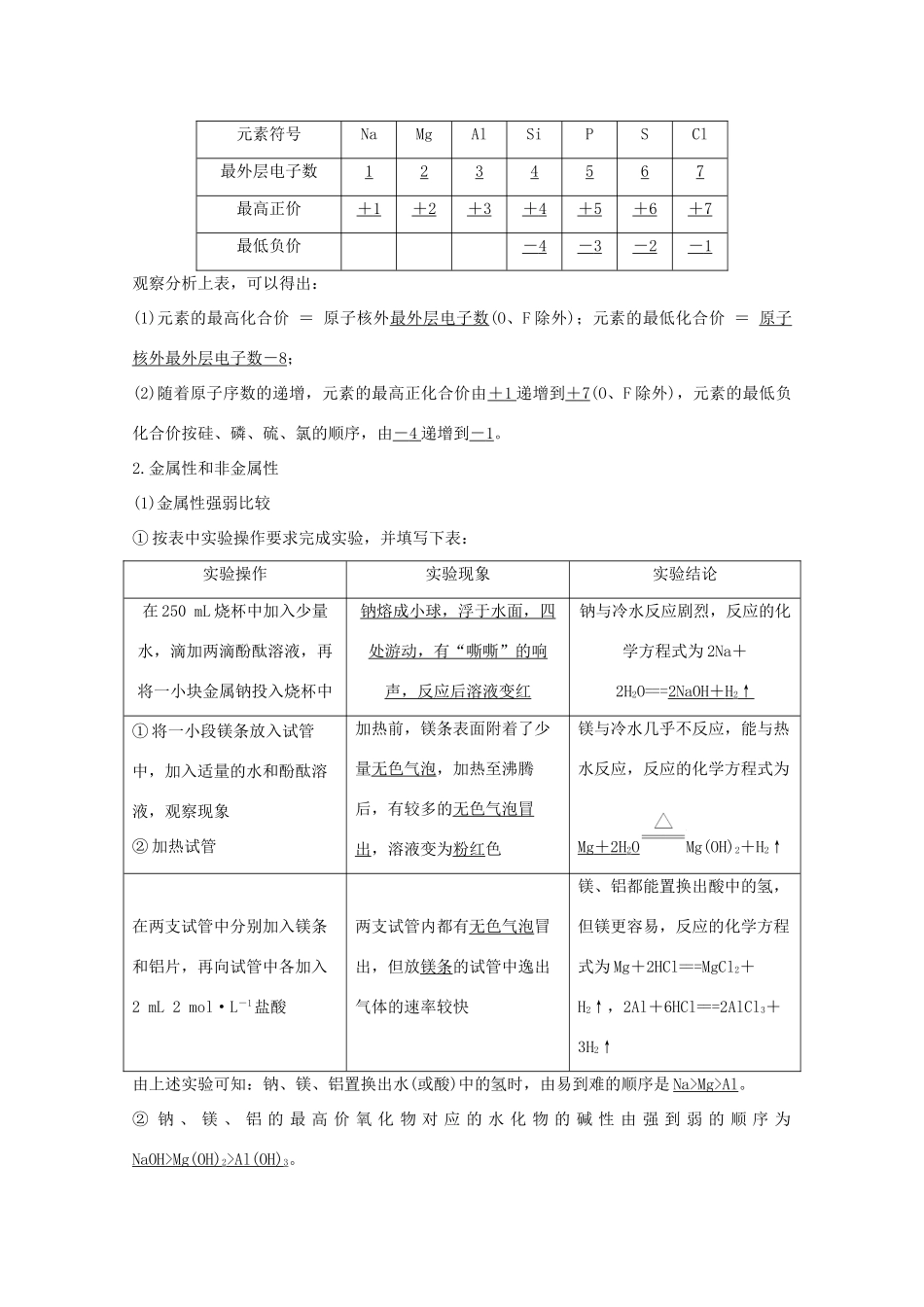
第2课时元素周期律学习目标核心素养建构1.通过分析1~18号元素原子核外电子排布、原子半径、主要化合价的变化,总结出它们的递变规律,并由此认识元素周期律。2.初步认识元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。[知识梳理]一、原子结构的周期性变化1.原子序数(1)概念:按核电荷数由小到大的顺序给元素编号,这种编号叫做原子序数。(2)数量关系:原子序数=质子数=核外电子数=核电荷数。2.原子结构变化规律(1)原子最外层电子排布的规律性变化观察上图回答问题:从3~18号元素随着原子序数的递增,最外电子层上的电子数重复出现从1递增到8的变化,说明元素原子的最外层电子排布呈现周期性变化。(2)元素原子半径的变化规律下表为原子序数为3~9和11~17元素的原子半径:3~9号3Li(锂)4Be(铍)5B(硼)6C(碳)7N(氮)8O(氧)9F(氟)元素原子半径/pm152111887770666411~17号元素11Na(钠)12Mg(镁)13Al(铝)14Si(硅)15P(磷)16S(硫)17Cl(氯)原子半径/pm18616014311711010499注:1pm=10-12m从上表可以得到:随着原子序数的递增,元素原子半径(稀有气体除外)呈现周期性变化。3~9号元素、11~17号元素原子半径随着核电荷数的递增都逐渐减小。【自主思考】1.“1~18号元素的原子半径随着核电荷数的递增逐渐减小”这句话是否正确?为什么?提示不正确。①3~9号元素,11~17号元素的原子半径随着核电荷数的递增逐渐减小,变化规律是周期性的,而不是一直减小;②2、10、18号等稀有气体元素的原子半径与其他元素的原子半径测定标准不同,不具有可比性。③核电荷数小的元素其原子半径不一定小,如Li>Cl。2.解释下列问题:(1)对于电子层数相同的原子,为什么其核电荷数越多,原子半径越小(稀有气体除外)?(2)最外层电子数相同的原子,原子半径的大小与什么因素有关?(3)原子序数越大,原子半径一定越大吗?提示(1)核电荷数越多,原子对核外电子的引力越大,原子半径越小。(2)电子层数。原子最外层电子数相同时,原子电子层数越多,原子半径越大。(3)不一定。电子层数相同的原子,原子序数越大,原子半径越小;最外层电子数相等的原子,原子序数越大,原子半径就越大;电子层数不同,最外层电子数也不同的原子,原子序数越大,原子半径不一定越大。二、元素周期律1.元素化合价填写下表:元素钠镁铝硅磷硫氯元素符号NaMgAlSiPSCl最外层电子数1234567最高正价+1+2+3+4+5+6+7最低负价-4-3-2-1观察分析上表,可以得出:(1)元素的最高化合价=原子核外最外层电子数(O、F除外);元素的最低化合价=原子核外最外层电子数-8;(2)随着原子序数的递增,元素的最高正化合价由+1递增到+7(O、F除外),元素的最低负化合价按硅、磷、硫、氯的顺序,由-4递增到-1。2.金属性和非金属性(1)金属性强弱比较①按表中实验操作要求完成实验,并填写下表:实验操作实验现象实验结论在250mL烧杯中加入少量水,滴加两滴酚酞溶液,再将一小块金属钠投入烧杯中钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液变红钠与冷水反应剧烈,反应的化学方程式为2Na+2H2O===2NaOH+H2↑①将一小段镁条放入试管中,加入适量的水和酚酞溶液,观察现象②加热试管加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,溶液变为粉红色镁与冷水几乎不反应,能与热水反应,反应的化学方程式为Mg+2H2OMg(OH)2+H2↑在两支试管中分别加入镁条和铝片,再向试管中各加入2mL2mol·L-1盐酸两支试管内都有无色气泡冒出,但放镁条的试管中逸出气体的速率较快镁、铝都能置换出酸中的氢,但镁更容易,反应的化学方程式为Mg+2HCl===MgCl2+H2↑,2Al+6HCl===2AlCl3+3H2↑由上述实验可知:钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序是Na>Mg>Al。②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3。③钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al。(2)非金属性强弱比较填写下表空格:元素SiPSCl最高价氧化物的化学式SiO2P2O5SO3Cl2O7最高价氧化物对应水化物的化学式及酸性H2SiO3弱酸H3PO4中强酸H2SO4强酸HClO4酸性更强单质与H2反应...