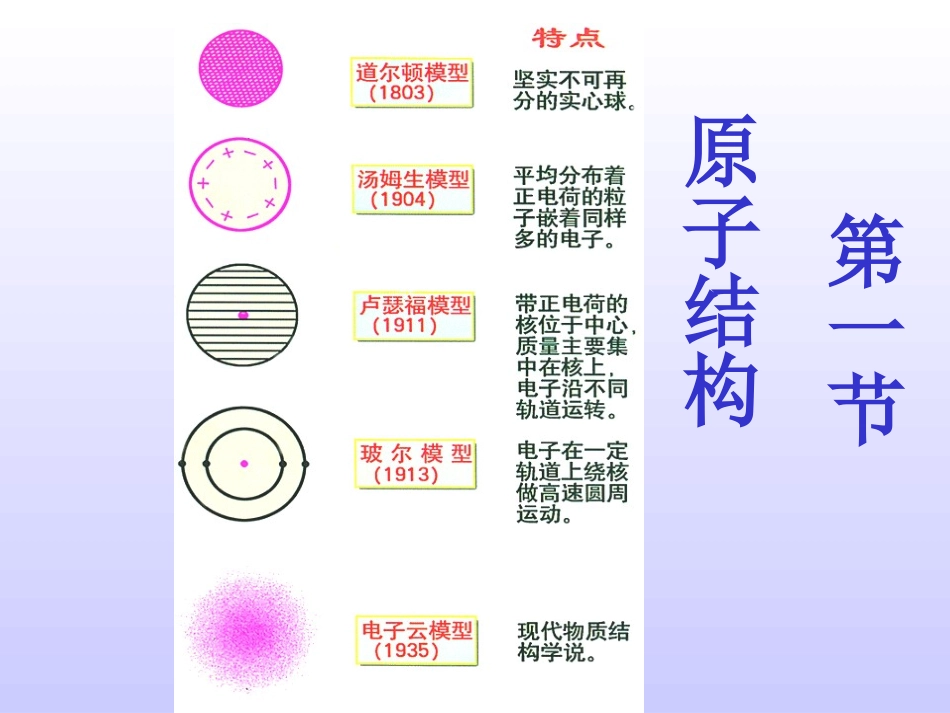
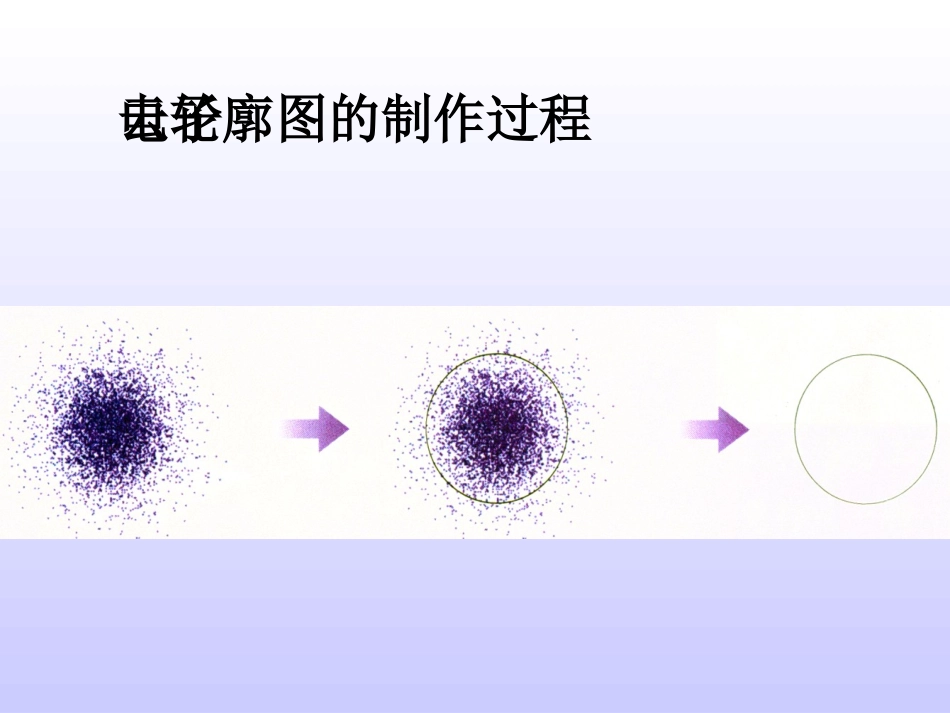
第一节原子结构11.exe氢原子的基态电子(即1s电子)的概率分布图的形成过程:电子云轮廓图的制作过程从1s电子的概率分布图的形成、制作过程中,你获得那些信息?(小黑点表示什么?疏密程度表示什么?)思考电子云:电子象一片云雾笼罩在原子核的周围,形象地称作电子云。(1)电子云中的小黑点并不表示电子或电子数,只表示电子在某一时刻在某一位置出现的机会的多少。(2)电子云中小黑点密集的地方电子出现的机会多;电子云中小黑点稀疏的地方电子出现的机会少。从1s,2s,3s能级的原子轨道图,你获得哪些信息?为什么?思考s电子云的形状及特点(1)s电子的原子轨道是球形的,原子核位于球心(2)能层序数n越大,原子轨道的半径越大原因:1s,2s,3s……电子的能量依次升高,电子在离核在离核更远的区域出现的概率逐渐增大。电子云越来越向更大的空间扩展。从p能级的电子云原子轨道图,你知道什么?p电子云的形状和特点:(1)p电子云是纺锤形的(2)每个p能级有3个原子轨道,它们相互垂直,分别以Px,Py,Pz表示(3)p电子原子轨道的平均半径也随能层序数n的增大而增大d,f能级的原子轨道图,了解d,f能级的原子轨道空间形象综上所知,不同的能级电子云形状各不相同,不同能级中又含有数目不同的轨道。s:1个;p:3个;d:5个;f:7个。通过观察第二周期元素基态原子的电子排布图,你获得哪些知识?思考与交流(1)每个方框表示一个原子轨道,每个箭头代表一个电子(2)ns能级有1个轨道,np能级有3个轨道,nd能级有5个轨道,nf能级有7个轨道……(3)每个轨道最多容纳2个电子,ns,np,nd,nf……能级最多容纳电子数为2×1,2×3,2×5,2×7……1个原子轨道最多只能容纳2个电子,而且自旋方向相反(用“↑↓”表示)——泡利原理当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。———洪特规则[小结]电子云形象地描述了核外电子的运动状况。各能级电子云形状各不相同,且含有不同数目的原子轨道,电子排布时,遵守能量最低原理,泡利原理和洪特规则练习:写出下列基态原子的轨道表示式:NaCaSiPBrFe