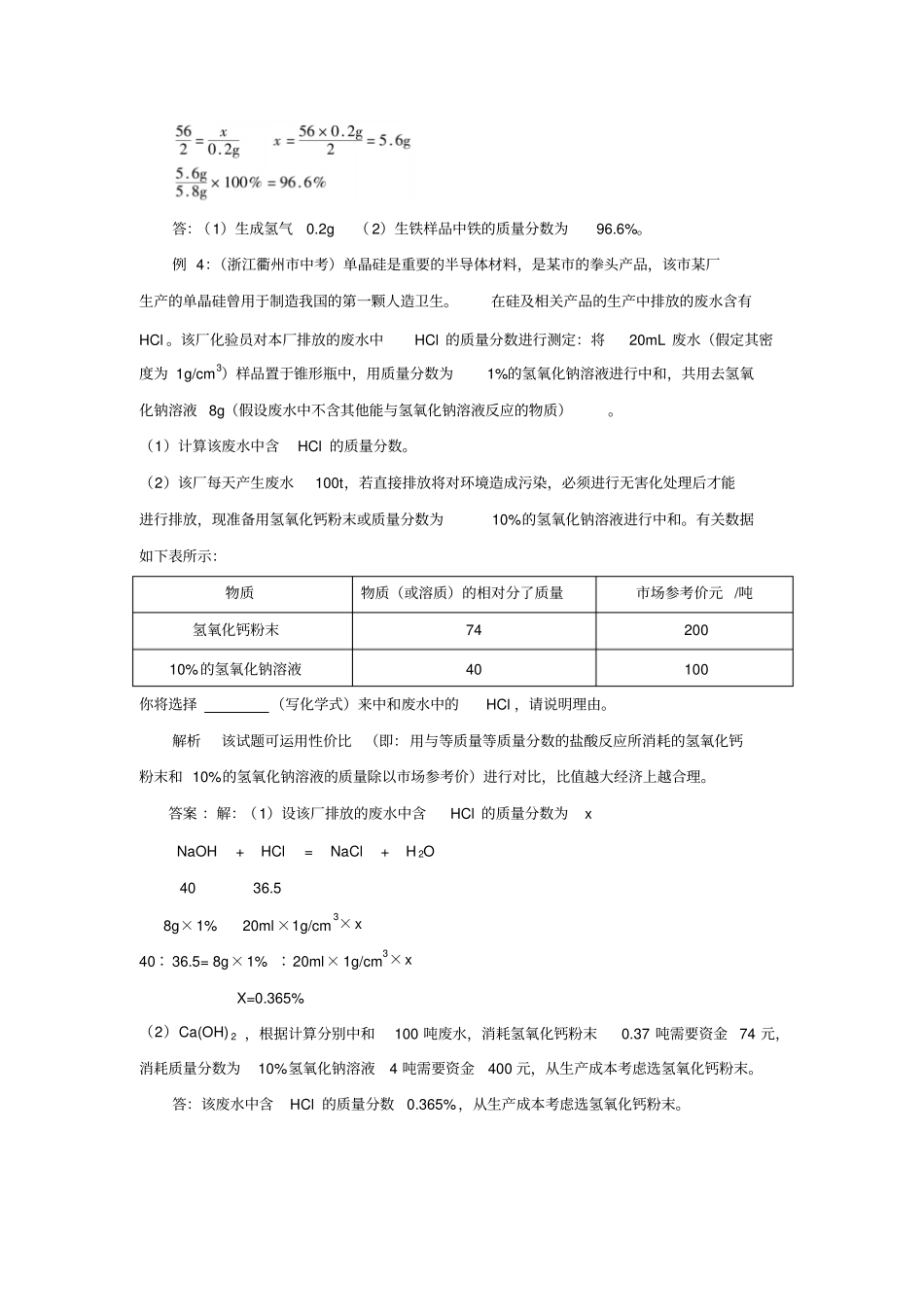
利用化学方程式的简单计算步骤:1、设未知量(未知数后不加单位);2、正确书写化学方程式(注意化学方程式的书写要完整、准确,指出若不配平,直接影响计算结果); 3、计算相关物质的相对分子质量; 4、标出已知量、未知量; 5、列出比例式;6、解比例式(结果保留两位小数);7、简明地写出答语。例 1:(南通市中考 ) 密闭容器内有A、B、C、D 四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:物质 A B C D反应前质量 /g 19.7 8.7 31.6 O. 4反应后质量 /g待测 17.4 0 3.6下列说法正确的是( ) A.物质 C一定是化合物B.反应后密闭容器中A 的质量为 19.7g C.反应过程中,物质B 与物质 D变化的质量比为87∶ 36 D.若物质 A 与物质 C的相对分子质量之比为197∶158,则反应中 A 与 C的化学计量数之比为 l ∶2 解析由题中所给的数据可知:C 反应后质量没有了,说明是反应物,而B、D 反应后质量都增加了,说明是生成物,C 反应掉 31.6g ,B、D 共生成的质量只有 11.9g ,说明A也生成物,且生成的质量为 19.7g ,则该反应为分解反应,C 一定是化合物,A、B、D可能是化合物,也可能是单质;然后由质量比、相对分子质量比求化学计量数比。答案 :AD 例 2:(北京市中考)甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH 3OH + nO 2mCO 2 + 2CO + 16H 2O。若反应生成3.6g 水,请计算:(1)m 值是(2)参加反应的氧气质量是多少克?(写出规范计算步骤)解析此题要求运用质量守恒定律,去确定化学计量数。质量守恒定律不仅体现在宏观上总质量相等、 元素的质量相等, 还体现在微观上原子个数相等。根据碳原子数反应前后相等, 8=m+2 ,m=6 ;反应前后氧原子个数为8+2n=6×2+2+16 , n=11 ,然后根据化学方程式,由生成3.6g 水,求参加反应的氧气的质量。答案:( 1)6( 2)8+2n=6×2+2+16 n=11 设参加反应的氧气质量为X 8CH3OH + 11O 26CO2 + 2CO + 16H 2O 11×32 16×18x 3.6g gx6.318163211x=4.4g 答:参加反应的氧气为4.4g。例 3:(江西省中考)化学兴趣小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室将 5.8g 生铁样品放入烧杯中,加入 50g 稀硫酸恰好完全反应(杂质不参加反应) ,反应后称得烧杯中剩余物质的总质量为55.6g 。求:(1)产生氢气的质量是多少?(2)...