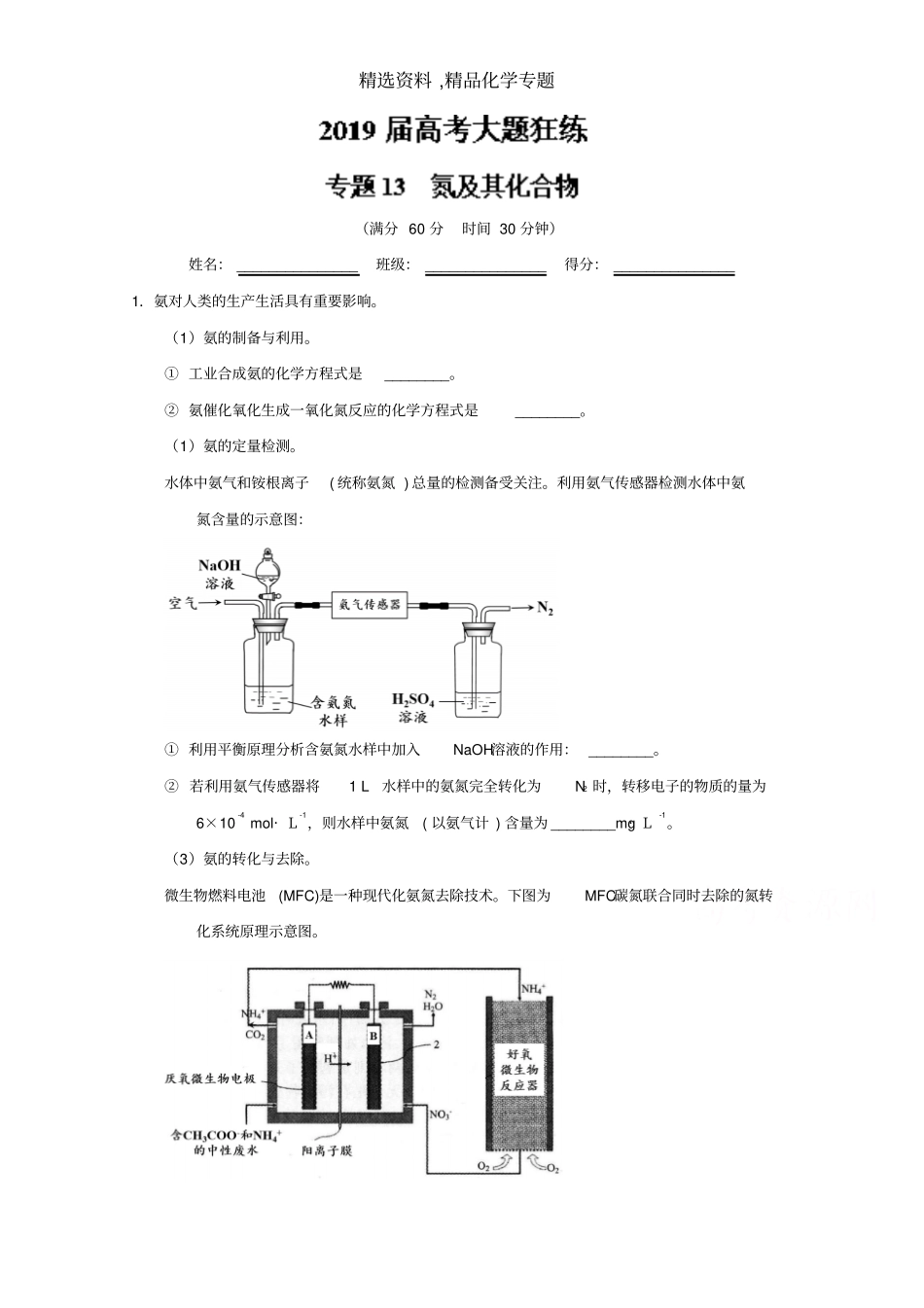
精选资料 ,精品化学专题(满分 60 分时间 30 分钟)姓名: _______________班级: _______________得分: _______________1.氨对人类的生产生活具有重要影响。(1)氨的制备与利用。① 工业合成氨的化学方程式是________。② 氨催化氧化生成一氧化氮反应的化学方程式是________。(1)氨的定量检测。水体中氨气和铵根离子( 统称氨氮 ) 总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: ________。② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2 时,转移电子的物质的量为6×10-4 mol· L-1,则水样中氨氮( 以氨气计 ) 含量为 ________mg· L-1。(3)氨的转化与去除。微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。精选资料 ,精品化学专题① 已知 A、B两极生成 CO2 和 N2 的物质的量之比为5 : 2,写出 A极的电极反应式: ________。② 用化学用语简述NH4+去除的原理: ________。【答案】-1 c(NaClO) 增大 , 水解平衡正向移动, 使 c(HClO) 增大 ,NH3被氧化为 N2速度加快。 ClO-+ H 2O HClO + OH- pH 较大时 ,c(OH-) 较大 , 抑制 NaClO 水解 ,c(HClO) 较小致氧化能力弱, 去除率降低。 pH 较小时 ,c(H+) 较大 , 促进 NaClO 水解 ,c(HClO) 太高致 HClO 易分解 ,去除率降低。负极 Cl- - 2e- + H 2O = H+ + HClO 【解析】本题考查工业上合成氨和氨催化氧化反应方程式的书写,外界条件对电离平衡的影响,氧化还原2.某化学课外活动小组利用下图所示装置探究NO2能否被 NH3还原 (K 1、K2为止水夹, 夹持固定装置略去 ) 。