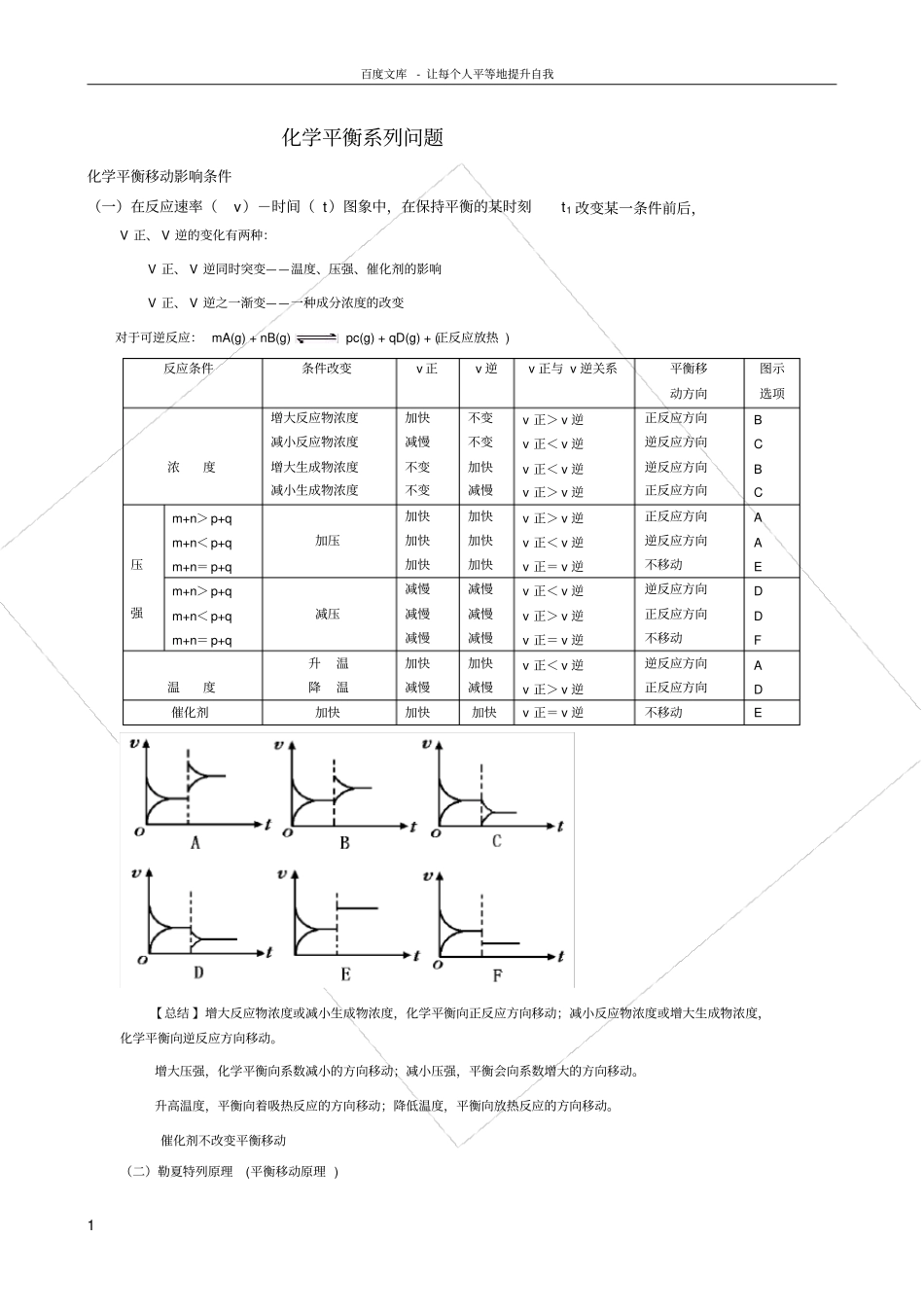
百度文库- 让每个人平等地提升自我1 化学平衡系列问题化学平衡移动影响条件(一)在反应速率(v)-时间( t)图象中,在保持平衡的某时刻t1 改变某一条件前后,V 正、 V 逆的变化有两种:V 正、 V 逆同时突变——温度、压强、催化剂的影响V 正、 V 逆之一渐变——一种成分浓度的改变对于可逆反应: mA(g) + nB(g) pc(g) + qD(g) + (正反应放热 )【 总结 】增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。增大压强,化学平衡向系数减小的方向移动;减小压强,平衡会向系数增大的方向移动。升高温度,平衡向着吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。催化剂不改变平衡移动(二)勒夏特列原理(平衡移动原理 ) 反应条件条件改变v 正v 逆v 正与 v 逆关系平衡移动方向图示选项浓度增大反应物浓度减小反应物浓度增大生成物浓度减小生成物浓度加快减慢不变不变不变不变加快减慢v 正> v 逆v 正< v 逆v 正< v 逆v 正> v 逆正反应方向逆反应方向逆反应方向正反应方向B C B C 压强m+n> p+q m+n< p+q m+n= p+q 加压加快加快加快加快加快加快v 正> v 逆v 正< v 逆v 正= v 逆正反应方向逆反应方向不移动A A E m+n> p+q m+n< p+q m+n= p+q 减压减慢减慢减慢减慢减慢减慢v 正< v 逆v 正> v 逆v 正= v 逆逆反应方向正反应方向不移动D D F 温度升温降温加快减慢加快减慢v 正< v 逆v 正> v 逆逆反应方向正反应方向A D 催化剂加快加快加快v 正= v 逆不移动E 百度文库- 让每个人平等地提升自我2 如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。具体地说就是:增大浓度,平衡就会向着浓度减小的方向移动;减小浓度,平衡就会向着浓度增大的方向移动。增大压强,平衡就会向着压强减小的方向移动;减小压强,平衡就会向着压强增大的方向移动。升高温度,平衡就会向着吸热反应的方向移动;降低温度,平衡就会向着放热反应的方向移动。平衡移动原理对所有的动态平衡都适用,如对后面将要学习的电离平衡,水解平衡也适用。(讲述: “减弱 ”“改变 ”不是 “消除 ”,更不能使之 “逆转 ”。例如,当原平衡体系中气体压强为P 时,若其它条件不变,将体系压强增大到2P,当达到新的平衡时,体系压强不会减弱至P 甚至小于 P,而...