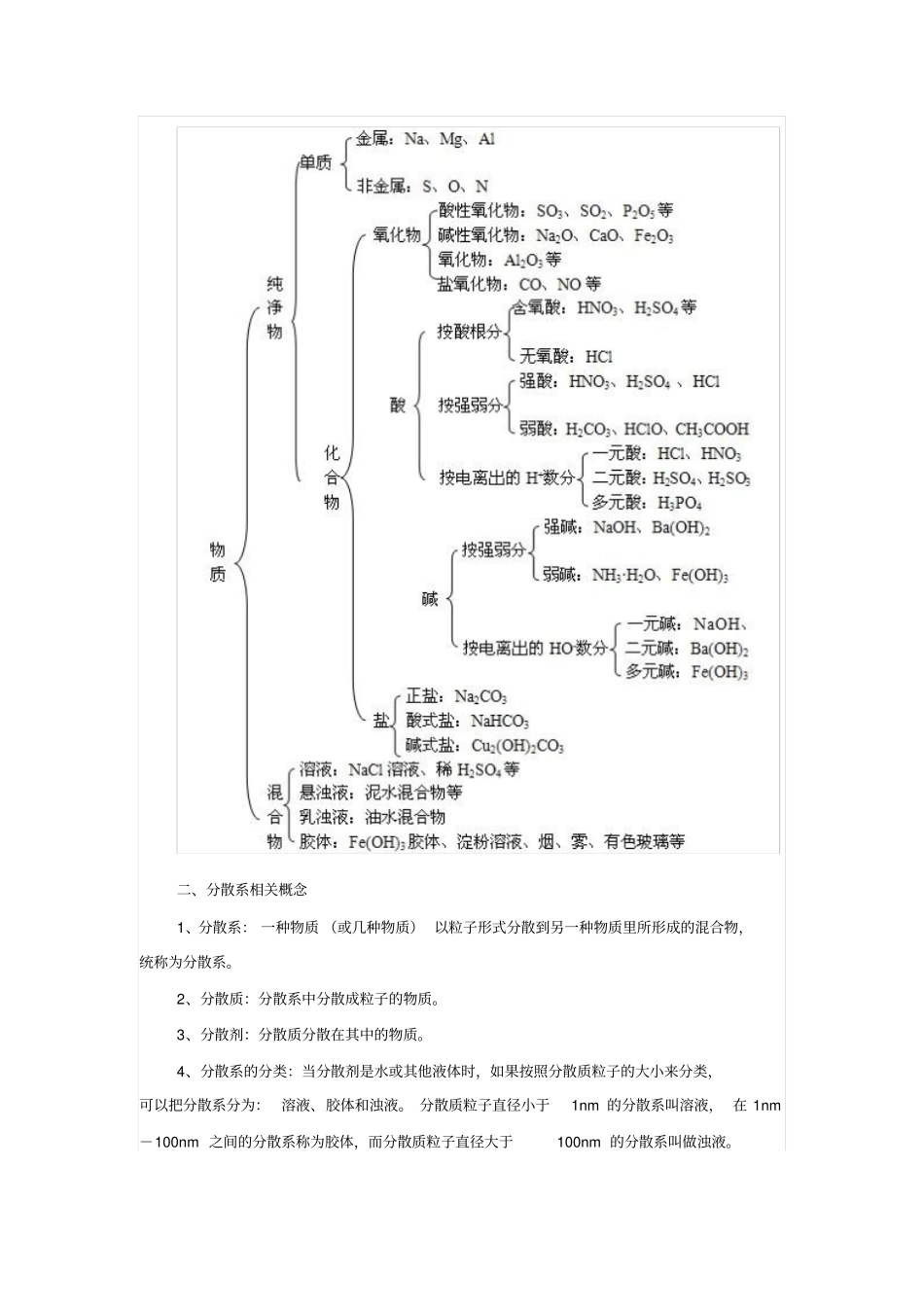
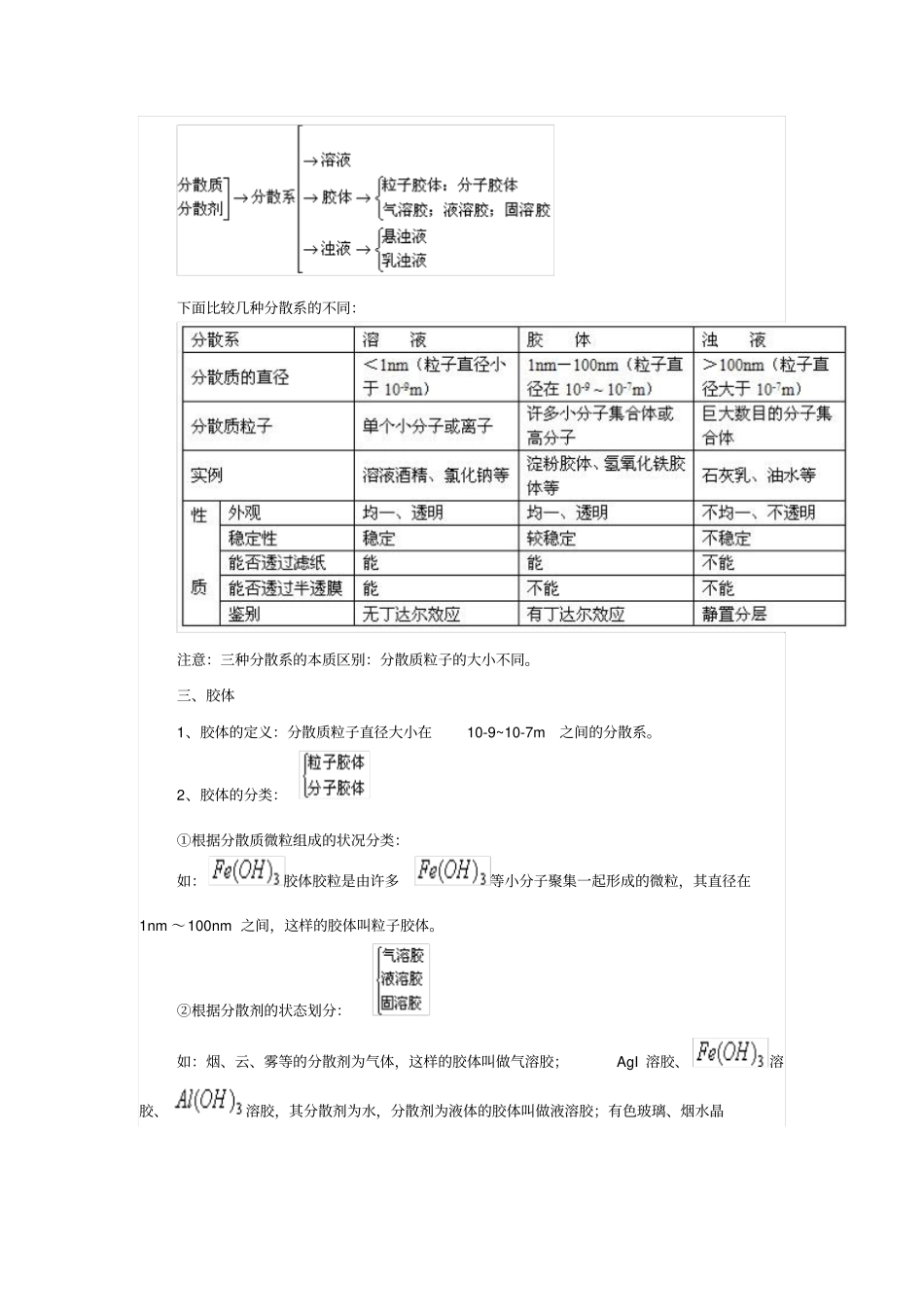
课标要求1.能根据物质的组成和性质对物质进行分类2.知道根据分散质粒子的大小,把分散系分为溶液、胶体和浊液3.知道用丁达尔效应区分溶液和胶体4.知道酸、碱、盐在溶液中能发生电离,能正确书写强酸、强碱和可溶性盐的电离方程式。5.通过实验事实认识离子反应的意义及其发生的条件,能正确书写常见的离子方程式。6.能够根据溶液中存在的离子判断是否发生复分解反应,从而判断溶液中离子能否大量共存。7.了解 Cl-、SO 42-、CO 32-等常见离子的检验方法。8.了解常见变化的分类方法。9.根据实验事实了解氧化还原反应的本质是电子的转移。10. 举例说明生产、生活中常见的氧化还原反应。11.熟记常见物质的化合价,能根据反应前后元素化合价有无变化,判断反应是否为氧化还原反应。12.能判断氧化剂和还原剂。要点精讲一、物质的分类二、分散系相关概念1、分散系: 一种物质 (或几种物质) 以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。2、分散质:分散系中分散成粒子的物质。3、分散剂:分散质分散在其中的物质。4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为: 溶液、胶体和浊液。 分散质粒子直径小于1nm 的分散系叫溶液, 在 1nm-100nm 之间的分散系称为胶体,而分散质粒子直径大于100nm 的分散系叫做浊液。下面比较几种分散系的不同:注意:三种分散系的本质区别:分散质粒子的大小不同。三、胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。2、胶体的分类:①根据分散质微粒组成的状况分类:如:胶体胶粒是由许多等小分子聚集一起形成的微粒,其直径在1nm ~100nm 之间,这样的胶体叫粒子胶体。②根据分散剂的状态划分:如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI 溶胶、溶胶、溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。3、胶体的制备A.物理方法①机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小②溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等。B.化学方法①水解促进法:FeCl 3+3H 2O(沸) =(胶体) +3HCl ②复分解反应法:KI+AgNO3=AgI (胶体) +KNO 3,Na 2SiO 3+2HCl=H 2SiO 3(胶体)+2NaCl 思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对...