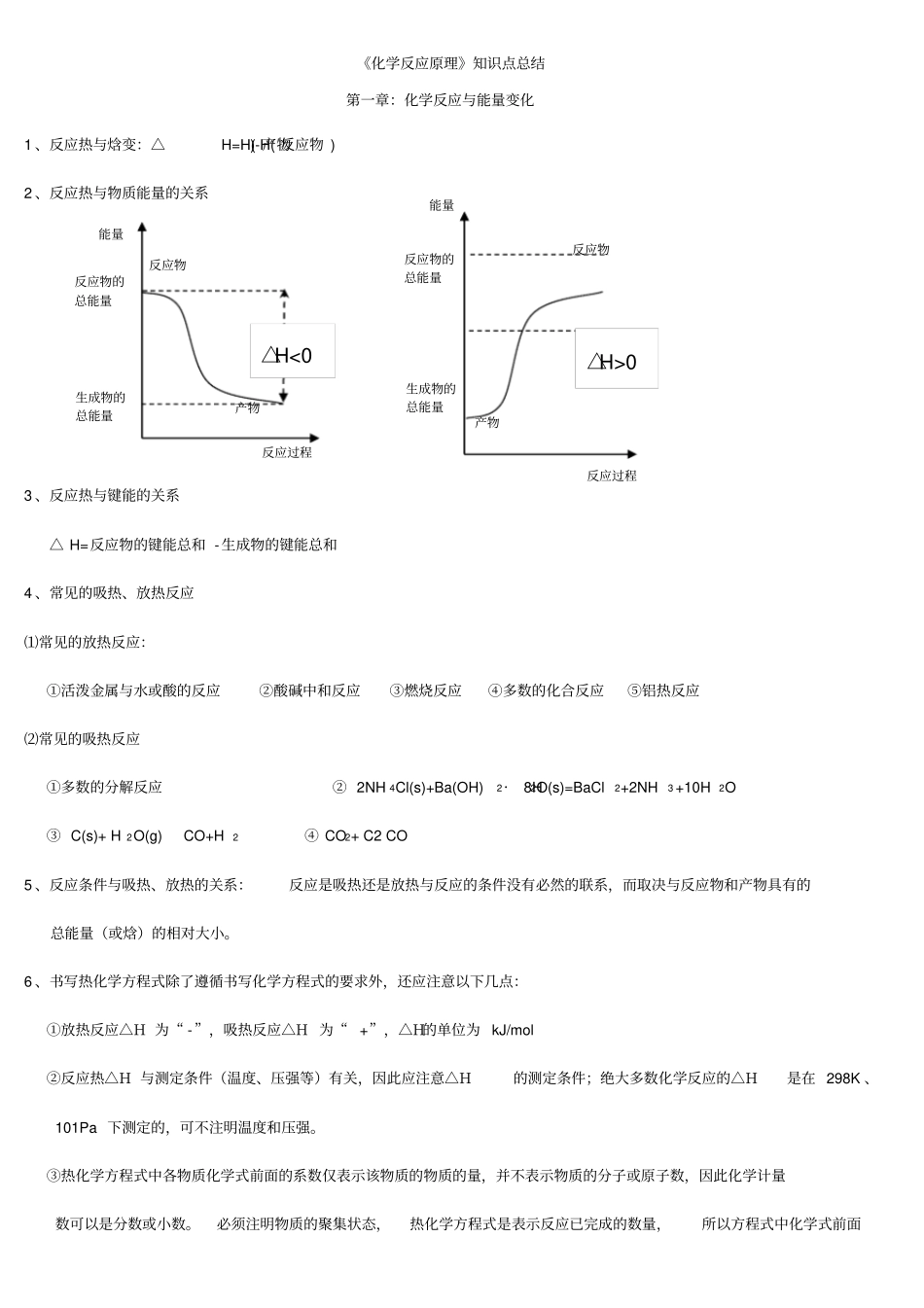
《化学反应原理》知识点总结第一章:化学反应与能量变化1 、反应热与焓变:△H=H( 产物)-H( 反应物 )2 、反应热与物质能量的关系3 、反应热与键能的关系△ H=反应物的键能总和 -生成物的键能总和4 、常见的吸热、放热反应⑴常见的放热反应:①活泼金属与水或酸的反应②酸碱中和反应③燃烧反应④多数的化合反应⑤铝热反应⑵常见的吸热反应①多数的分解反应② 2NH 4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3 +10H2O③ C(s)+ H 2O(g)CO+H2④ CO2+ C2 CO5 、反应条件与吸热、放热的关系:反应是吸热还是放热与反应的条件没有必然的联系,而取决与反应物和产物具有的总能量(或焓)的相对大小。6 、书写热化学方程式除了遵循书写化学方程式的要求外,还应注意以下几点:①放热反应△H 为“ -”,吸热反应△H 为“ +”,△H的单位为 kJ/mol②反应热△H 与测定条件(温度、压强等)有关,因此应注意△H的测定条件;绝大多数化学反应的△H是在 298K 、101Pa 下测定的,可不注明温度和压强。③热化学方程式中各物质化学式前面的系数仅表示该物质的物质的量,并不表示物质的分子或原子数,因此化学计量数可以是分数或小数。必须注明物质的聚集状态,热化学方程式是表示反应已完成的数量,所以方程式中化学式前面能量反应物反应过程反应物的总能量产物生成物的总能量△H<0反应物产物反应过程能量反应物的总能量生成物的总能量△H>0的计量数必须与△H相对应;当反应逆向进行时,反应热数值相等,符号相反。7、利用盖斯定律进行简单的计算8、电极反应的书写:活性电极:电极本身失电子⑴电解:阳极: (与电源的正极相连)发生氧化反应惰性电极:溶液中阴离子失电子(放电顺序: I->Br ->Cl ->OH-)阴极 :(与电源的负极相连)发生还原反应,溶液中的阳离子得电子(放电顺序: Ag + >Cu 2+ >H + )注意问题:①书写电极反应式时,要用实际放电的离子....... 来表示②电解反应的总方程式要注明“通电”③若电极反应中的离子来自与水或其他弱电解质的电离,则总反应离子方程式中要用化学式表示⑵原电池:负极:负极本身失电子,M→Mn+ + ne -① 溶液中阳离子得电子N m+ +m e -→N 正极 :2H ++2e -→H 2↑ ②负极与电解质溶液不能直接反应:O 2+4e -+2H2O→ 4OH -(即发生吸氧腐蚀)书写电极反应时要注意电极产物与电解质溶液中的离子是否反应,若反应,则在电极反应中应写最终产物。9、电解...