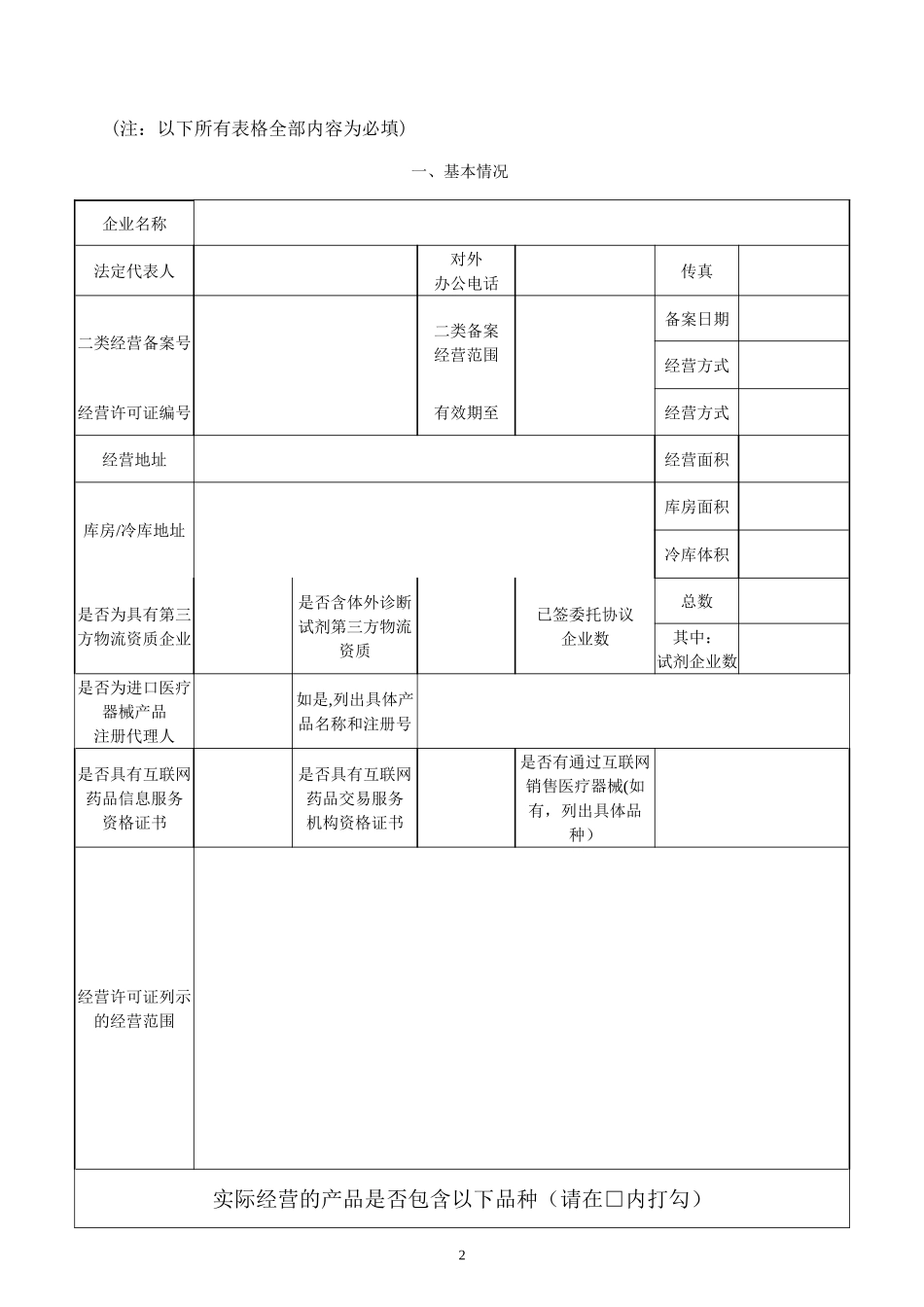
医疗器械经营企业质量管理自查报告企业名称:报告时间:1(注:以下所有表格全部内容为必填)一、基本情况企业名称法定代表人对外办公电话传真二类经营备案号二类备案经营范围备案日期经营方式经营许可证编号有效期至经营方式经营地址经营面积库房/冷库地址库房面积冷库体积是否为具有第三方物流资质企业是否含体外诊断试剂第三方物流资质已签委托协议企业数总数其中:试剂企业数是否为进口医疗器械产品注册代理人如是,列出具体产品名称和注册号是否具有互联网药品信息服务资格证书是否具有互联网药品交易服务机构资格证书是否有通过互联网销售医疗器械(如有,列出具体品种)经营许可证列示的经营范围实际经营的产品是否包含以下品种(请在□内打勾)2一、无菌类 □ 1.一次性使用无菌注射器(含自毁式、胰岛素注射、高压造影用)6815 □ 2。一次性使用无菌注射针(含牙科、注射笔用)6815 □ 3。一次性使用输液器(含精密、避光、压力输液等各型式)6866 □ 4。一次性使用静脉输液针 6815、6866 □ 5.一次性使用静脉留置针 6815 □ 6。一次性使用真空采血器 6815、6866 □ 7。一次性使用输血器 6866 □ 8.一次性使用塑料血袋 6866 □ 9。一次性使用麻醉穿刺包 6866 □ 10。 人工心肺设备辅助装置(接触血液的管路、滤器等)6845、6866 □ 11.血液净化用器具(接触血液的管路、过滤/透析/吸附器械)6845 □ 12。氧合器 6845 □ 13.血管内造影导管 6877 □ 14。球囊扩张导管 6877 □ 15。中心静脉导管 6866、6877 □ 16.外周血管套管 6877 □ 17.动静脉介入导丝、鞘管 6877 □ 18.血管内封堵器械(含封堵器、栓塞栓子、微球)6877 □ 19.医用防护口罩、医用防护服 6864□ 无二、植入材料和人工器官类 □ 1.普通骨科植入物(含金属、无机、聚合物等材料的板、钉、针、棒、丝、填充、修复材料等)6846 □ 2。脊柱内固定器材 6846 □ 3。人工关节 6846 □ 4.人工晶体 6822 □ 5。血管支架(含动静脉及颅内等中枢及外周血管用支架)6846 □ 6.心脏缺损修补/封堵器械 6877 □ 7.人工心脏瓣膜 6846 □ 8。血管吻合器械(含血管吻合器、动脉瘤夹)6846 □ 9。组织填充材料(含乳房、整形及眼科填充等)6846 □ 10.医用可吸收缝线 6865 □ 11。同种异体医疗器械 6846 □ 12。动物源医疗器械 6846□ 无三、体外诊断试剂类 □ 1。人传染高致病性病原微生物(第三、四类危害)...