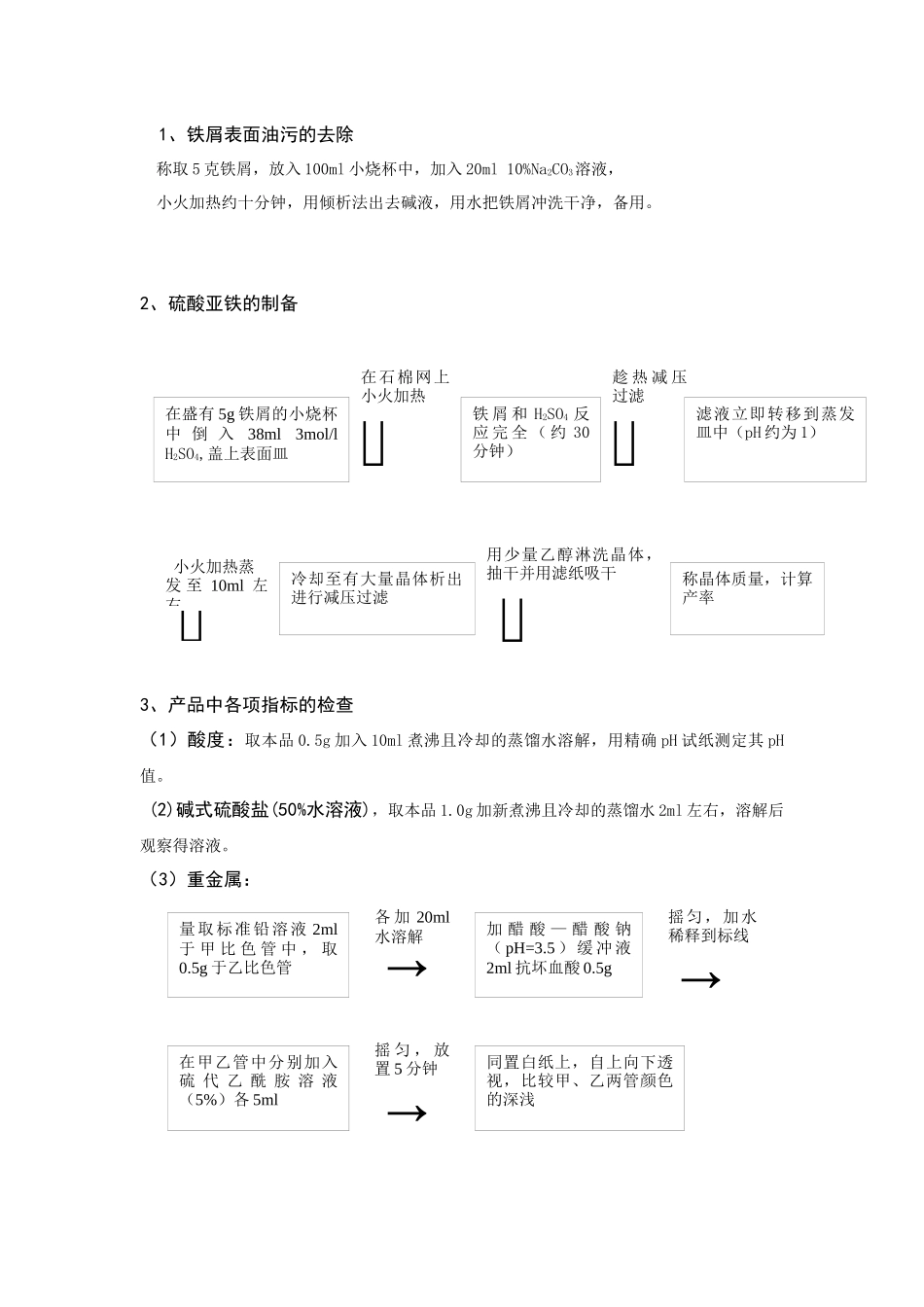
贫血药硫酸亚铁(FeSO4·7 H2O)的制备及组成含量分析学校 姓名 专业 学号前言部分摘要: 硫酸亚铁为抗贫血药。它可通过铁屑与稀硫酸的反应制成,从水溶液中结晶一般为 FeSO4·7 H2O。由于硫酸亚铁的亚铁离子具有还原性,在酸性条件下,可与 高锰酸钾发生发应,因此可以利用已知准确浓度的高锰酸钾溶液测定产品中的硫酸亚铁的含量,微过量的高锰酸根离子使溶液呈现微红色,指示终点。硫酸亚铁容易溶解于水、甘油,不溶于乙醇。1 份可溶解于 2 份冷水,或 0.35 份沸水中。 高温分解 2 FeSO4·7 H2O ==高温== Fe2O3+SO2↑+SO3↑+14 H2O。硫酸亚铁是还原力的酸性盐,它的酸性与硫酸铝及硫酸锌比则较弱。如硫酸亚铁的 pH 值约为 4.6,而硫酸铝则为 2.2,硫酸锌为 3.6(以克分子溶液计)。硫酸亚铁的 7 水合物是绿色小晶体,无臭有毒,比重 1.8987。在 56.6℃时 ,7 水合物转变为 4 水合物,64.4℃时变为 1 水合物。久置潮湿空气中也能潮解,暴露在乾燥空气里容易风化,晶体的表面渐渐变为白色粉末,但易为空气氧化而呈黄色或铁锈色。纯粹的硫酸亚铁晶体或溶液大都呈天蓝色,经氧化后,徐徐变成绿色,最后呈铁锈色。晶体的最好洁净剂和保存剂是酒精,酒精不但能溶解硫酸铁和氯化铁,并能除去促起氧化作用的水分。硫酸亚铁储存于阴凉、通风的库房。远离火种、热源。防止阳光直射。包装必须密封,切勿受潮。应与氧化剂、碱类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。 硫酸亚铁是一种重要的化工原料,用途十分广泛。近年来用作吸附剂、净化剂和催化剂。在无机化学工业中,它是制取其他铁化合物的原料,如用于制造氧化物系的颜料、磁性材料、黄色盐和其他铁盐。此外,它又有多方面的直接应用,如做净水剂,可用于作印染工业的媒染剂,制革工业中用于鞣革,木材工业中用作防腐剂,在医学中用于缺铁性贫血的治疗药物,农业中用于缺铁性土壤,畜牧业中用作饲料添加剂。还可用于鞣酸、没食子酸等配置蓝黑墨水。关键词 铁屑 硫酸亚铁 高锰酸钾 减压过滤 实验部分一、实验目的:1、了解无机药物的一般制备方法。2、了解无机药物的常用检测指标与检测方法。3、分析并评价硫酸亚铁制备的最佳反应条件和手法.4、进一步认识和掌握铁以及硫酸亚铁的化学性质5、分析评价硫酸亚铁晶体制备的最佳反应条件和操作方法。 6、熟悉并掌握水浴加热、热过滤、冷却结晶等基本操作。 二、实验原理:硫铁矿烧渣中含有 Fe2...