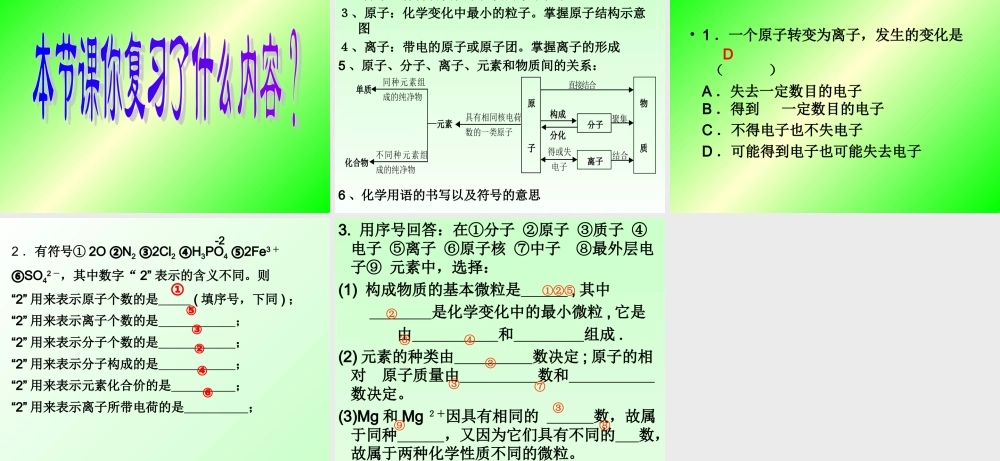
第四单元物质构成的奥秘 1 、物质是由 ________ 、 ________ 、 ________ 等微粒构成的。2 、分子是保持物质 ______________ 的最小粒子;原子是 _______________ 中最小的粒子。分子与分原子的本质区别是:在 变化中 可再分, 不可再分;3 、离子是带电的 ________________________ 。4 、写出下列粒子表示的意义或符号甲 3O2-表示 _________ 氮原子 _____ 氯离子 _____ 3 个水分子 _____ 2 个硫原子 _____5 、甲元素的原子结构示意图如右: ⑴ 甲原子核内质子数为 ____ ,最外电子层有 个电子,这种原子容易 ________ 电子,形成 ____ (填“阴”或“阳”)离子。每天开心一测+112 8 1甲分子 原子 离子化学性质化学变化化学分子原子原子或原子团3 个氧离子NCl-3H2O2S111失去 1 个阳 基本概念_识记1、构成物质的粒子有:分子、原子、离子。2、分子:保持物质化学性质的最小粒子。3、原子:化学变化中最小的粒子。4、离子:带电的原子或原子团。 要点、考点聚焦1.构成物质的粒子:分子、原子、离子及它们的定义理解。2.能正确书写常用的化学用语。理解化学用语的涵义并能正确应用。 3. 知识网络一、物质的组成和构成物 质元 素 构成 组成分子原子离子原子核 (+)核外电子(-)质子 (+)中子 ( 不带电 )相对原子质量=质子数+中子数 构成得失电子在原子中,质子数=核电荷数=核外电子数在离子中,质子数=核电荷数=核外电子数 典型例题解释:原子种类原子核核外电子数相对原子质量质子数中子数氢( H )10氦( He )24氮( N )714氧( O )88铁( Fe )2630铀 235( U-235 )92143112277816265692235 [ 例 2] .科学研究证明,物质是由微粒构成的。请用原子、分子或离子填空: (1) 应用最广泛的铁是由铁 构成的;(2) 保持氮气化学性质的是氮 ;(3) 调味用的氯化钠是由钠 和氯 构成的。 典型例题解析原子分子离子离子 [ 例 3]. 我国计划在 2007 年发射一颗绕月探测卫星,其任务之一是寻找一种——新能源氦 3 。氦 3 原子核是由一个中子和两个质子构成的,其原子核外电子数为 ( )A.1 B.2 C.3 D.6B 典型例题解析 各元素在地壳中的含量;1. 地壳中各元素的质量分数由多到少排列正确的是 ( ) A .氧、铝、硅、铁 B .硅、氧、铁、铝 C .铁、铝、氧、硅 D .氧、硅、铝、铁2. 地壳中的含量最多的金属元素是 ,最...