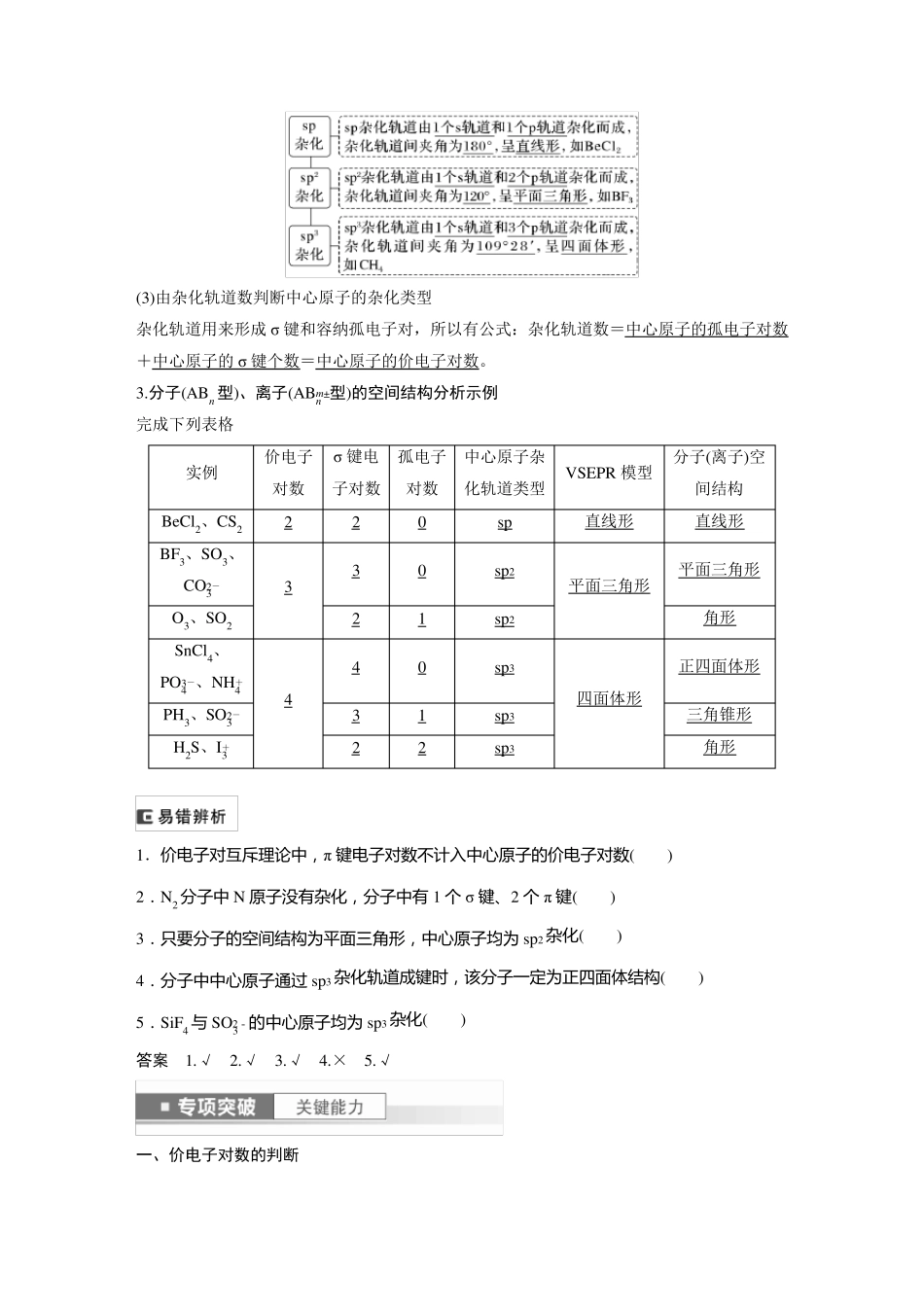
第29 讲 价电子对互斥理论、杂化轨道理论及应用 [复习目标] 1.能运用相关的理论来解释或预测简单分子(离子)的空间结构。2.掌握键角大小原因解释的规范描述。 1.价电子对互斥(VSEPR)理论 (1)理论要点 ①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。 ②孤电子对排斥力较大,孤电子对越多,排斥力越强,键角越小。 (2)价电子对互斥理论推测分子(离子)的空间结构的关键——价电子对数的计算 价电子对数=σ 键电子对数+中心原子的孤电子对数 说明:σ 键电子对数=中心原子结合的原子数;中心原子的孤电子对数=12(a-xb),其中 ①a 表示中心原子的价电子数。 对于主族元素:a=原子的最外层电子数。 对于阳离子:a=中心原子的价电子数-离子的电荷数。 对于阴离子:a=中心原子的价电子数+离子的电荷数(绝对值)。 ②x 表示与中心原子结合的原子数。 ③b 表示与中心原子结合的原子最多能接受的电子数(氢为1,其他原子=8-该原子的价电子数。如氧和氧族元素中的S、Se 等均为2,卤族元素均为1)。 例如,SOCl2 的空间结构的判断: SOCl2 的中心原子为S,σ 键电子对数为3,孤电子对数为12×(6-1×2-2×1)=1,价电子对数为4,这些价电子对互相排斥,形成四面体形的VSEPR 模型,由于中心原子上有1 个孤电子对,则SOCl2 的空间结构为三角锥形。 2.杂化轨道理论 (1)杂化轨道理论概述 中心原子上若干不同类型(主要是s、p 轨道)、能量相近的原子轨道混合起来,重新组合成同等数目、能量完全相同的新轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。 (2)杂化轨道三种类型 (3)由杂化轨道数判断中心原子的杂化类型 杂化轨道用来形成σ 键和容纳孤电子对,所以有公式:杂化轨道数=中心原子的孤电子对数+中心原子的σ 键个数=中心原子的价电子对数。 3.分子(ABn 型)、离子(ABm±n 型)的空间结构分析示例 完成下列表格 实例 价电子对数 σ 键电子对数 孤电子对数 中心原子杂化轨道类型 VSEPR 模型 分子(离子)空间结构 BeCl2、CS2 2 2 0 sp 直线形 直线形 BF3、SO3、CO2-3 3 3 0 sp2 平面三角形 平面三角形 O3、SO2 2 1 sp2 角形 SnCl4、PO3-4 、NH+4 4 4 0 sp3 四面体形 正四面体形 PH3、SO2-3 3 1 sp3 三角锥形 H2S、I+3 2 2 sp3 角形 1.价 电 子 对 互 斥 理 论 中 , π 键 电 子 对 数 不...