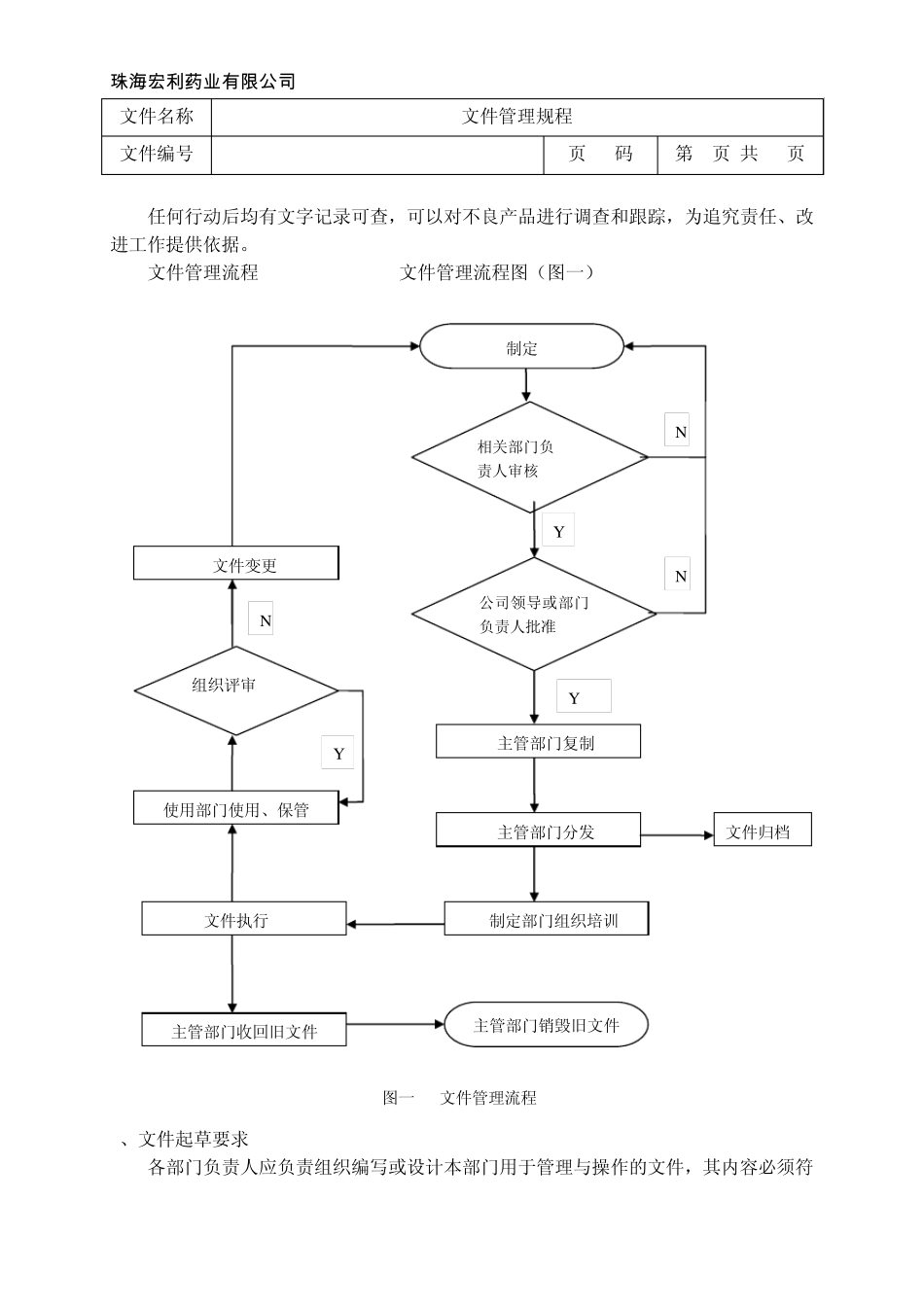
珠 海 宏 利 药 业有限公司 文件名称 文件管理规程 页 码 第1页/共14页 文件编号 SMP-08-00-001-00 生效日期 年 月 日 起 草 人 质量部QA 日 期 年 月 日 审 核 人 质量部QA主管 日 期 年 月 日 批 准 人 质量部经理 日 期 年 月 日 颁发部门 质量部 日 期 年 月 日 分发部门 行政人事部、物流部、质量部、生产部、销售部、财务部、物业部 目的:建立文件管理规程,用于 GMP文件系统的设计,起草、修订、审核、批准、生效、替换或撤销、复制、发放、保管和销毁、周期复核的管理办法,规范各类文件的编写模式及管理,形成具有企业特色、具有可操作性的、符合 GMP要求的管理文件。 范围:公司所有用于 GMP管理的文件。 职责:1、质量部负责 GMP文件的管理和审核; 2、各有关部门对本规程的实施负责。 依据:1、《药品生产质量管理规范》2010年版 2、药品 GMP指南 《质量管理体系》 内容: 1、定义:本规程所指的文件包括质量标准、工艺规程、操作规程、记录、报告等。 1.1 质量标准:质量标准是质量评价的基础,是保证产品质量、安全性、有效性和一致性的重要因素。 1.2 工艺规程:工艺规程是指为生产特定数量的成品而制定的一个或一套文件,包括生产处方、生产操作要求和包装操作要求,规定原辅料和包装材料的数量、工艺参数和条件、加工说明(包括中间控制)、注意事项等内容。 1.3 操作规程:操作规程是指经批准用来指导设备操作、维护与清洁、验证、环境控制、取样和检验等药品生产活动的通用性文件,也称标准操作规程。 1.4 记录、报告 1.4.1 记录:记录是反映实际生产活动实施结果的书面文件,药品生产的所有环节到检验到销售都是要有记录可查证追溯。包括:岗位操作记录、批生产记录、批检验记录、质量管理记录、各种台账、工程维修记录等。 1.4.2 报告:药品申请报告、产品质量回顾报告、验证报告、质量审计报告、各种检验报告等。 2、建立 GMP文件系统的目的及流程 2.1 明确规定保证高质量产品的企业质量管理体系。 2.2 行动可否进行以文字为准,一切活动有章可循、责任明确、照章办事、有章可查,以达到有效管理的最终目的。一个行动如何进行只有一个标准,保证有关人员收到有关指令并切实执行,规范操作者的行为,保证对 GMP的遵循。 珠 海 宏 利 药 业有限公司 文件名称 文件管理规程 文件编号 SMP-08-00-001-00 页 码 第2页/共14页...