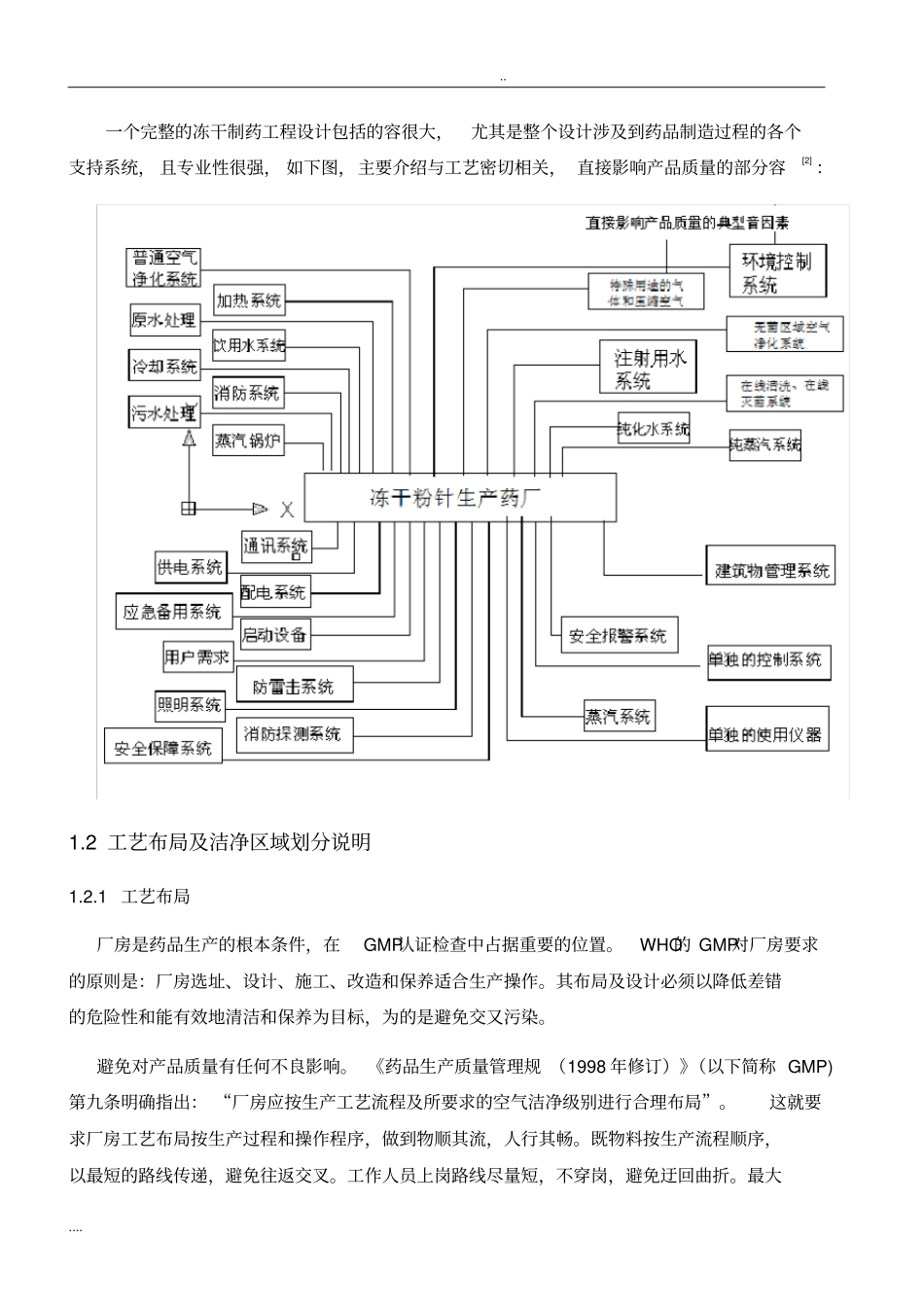
.. .... 年产 500 万支冻干灭活疫苗生产车间工艺设计计划书1 工艺概述1.1 工艺特性《药品生产质量管理规》 (GMP)明确指出,药品的质量不是通过检查或检验出来的,药品作为特殊性质的产品, 其质量、安全性和疗效是通过设计并在生产过程中赋予的。要获得优质的药品,必须控制药品生产的全过程,以确保成平符合预定质量标准。冻干药品的无菌特性, 要求对产品可能导致的各种污染进行严格而且有效的控制。冻干粉针剂是将药物的灭菌水溶液无菌灌装后,进行冷冻干燥而制成的注射用粉末。产品的形态决定了生产工艺条件, 工艺设备的选择和主要公用工程设施设计方式。同样,冻干疫苗产品的包装类型,包括西林瓶或预填装注射器等,其中任一种产品的最后包装形式对厂房、设备、设施的设计都有不同的特殊要求一个优秀的药品生产工艺流程,总是围绕如何确保药品质量和较高的设计标准,同时又能够最大限度的节约制品成本。通用的生产线实施流程如下图设计初步设计施工设计设备设计材料采购施工安装试车生产线实施流程设计的基本方法是, 在设计中考虑原辅料、 人员以及药品的无菌制造过程之间的有机联系。在设计过程中,应对产品的品种、规模、药品的性质等加以完整考虑,不仅要考虑设备设施的初始成本,还应该确定设备\ 设施的最经济寿命周期成本。.. .... 一个完整的冻干制药工程设计包括的容很大,尤其是整个设计涉及到药品制造过程的各个支持系统, 且专业性很强, 如下图,主要介绍与工艺密切相关, 直接影响产品质量的部分容[2] :1.2 工艺布局及洁净区域划分说明1.2.1 工艺布局厂房是药品生产的根本条件,在GMP认证检查中占据重要的位置。WHO的 GMP对厂房要求的原则是:厂房选址、设计、施工、改造和保养适合生产操作。其布局及设计必须以降低差错的危险性和能有效地清洁和保养为目标,为的是避免交又污染。避免对产品质量有任何不良影响。 《药品生产质量管理规 (1998 年修订)》(以下简称 GMP)第九条明确指出: “厂房应按生产工艺流程及所要求的空气洁净级别进行合理布局”。这就要求厂房工艺布局按生产过程和操作程序,做到物顺其流,人行其畅。既物料按生产流程顺序,以最短的路线传递,避免往返交叉。工作人员上岗路线尽量短,不穿岗,避免迂回曲折。最大.. .... 限度地减少差错和交叉污染。工艺布局不当不仅会导致操作不便,人流物流混乱,造成差错、污染,也不利于设备的安装、清洗、维护、检修,而巨影响净化...