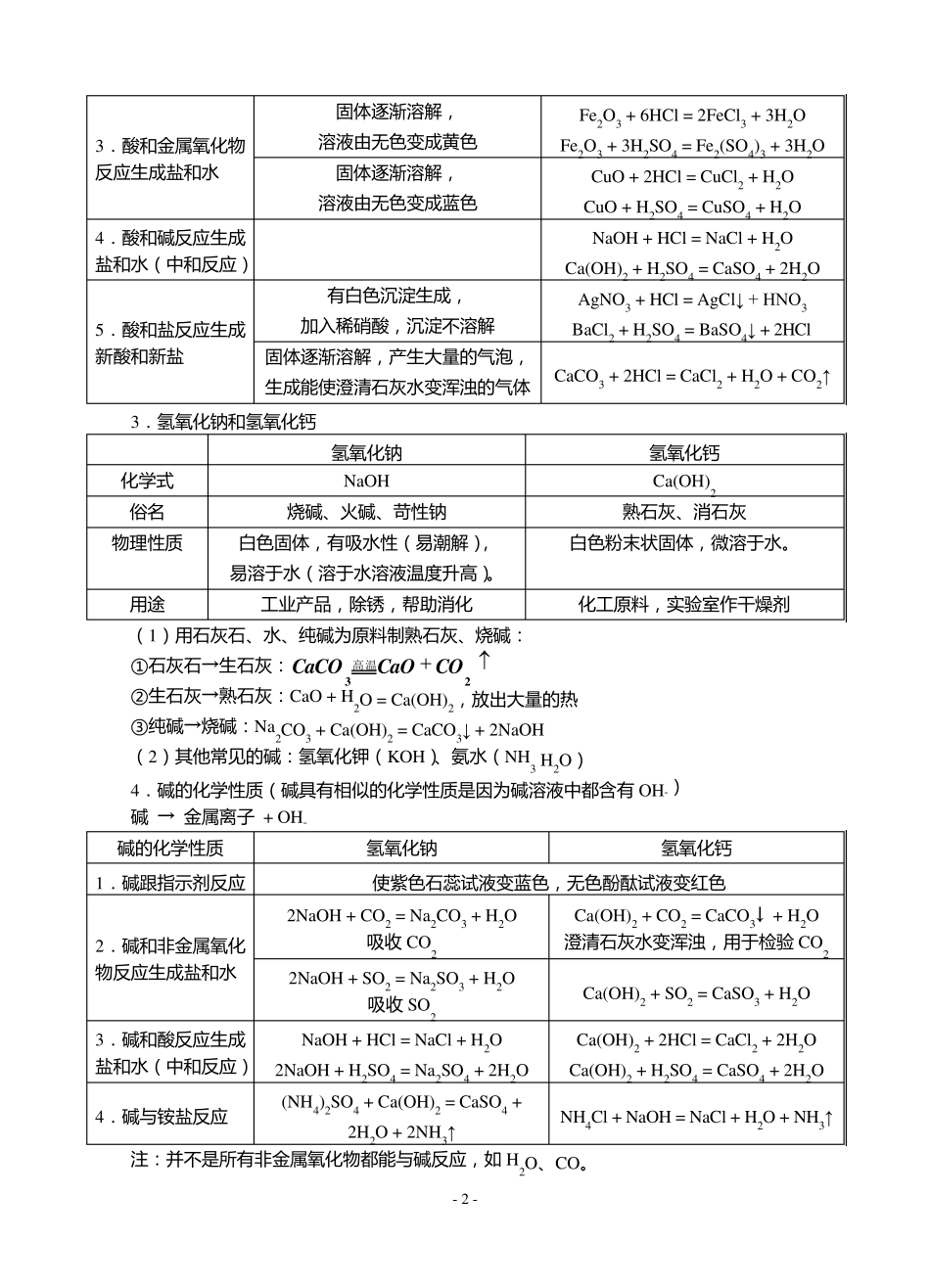
- 1 - 酸 、碱、盐知识点归纳 一、常见的酸和碱 1.盐酸和硫酸 盐酸 硫酸 化学式 HCl H2SO4 最大溶质质量分数 37.5% 98% 物理性质(浓) 无色液体,有挥发性(打开瓶盖观察到有白雾),有刺激性气味。 无色粘稠状液体,无挥发性,有吸水性。 用途 工业产品,除锈,帮助消化 化工原料,实验室作干燥剂 注:盐酸是氯化氢气体溶于水形成的溶液,属于混合物。 (1)浓盐酸的挥发性:盐酸的溶质的质量分数越大,挥发性越强。 雾是小液滴,烟是固体小颗粒,浓盐酸挥发出的氯化氢(HCl)气体与遇空气中的水蒸气形成盐酸小液滴,不是白烟。 (2)敞口放置浓盐酸和浓硫酸: 溶质 溶剂 溶液 溶质的质量分数 浓盐酸 ↘ — ↘ ↘ 浓硫酸 — ↗ ↗ ↘ (3)浓硫酸的特性:吸水性(物)、腐蚀性(化)、脱水性(化,是腐蚀性的一种) (4)浓硫酸的稀释:将浓硫酸沿器壁慢慢倒入装有水的烧杯中,并不断搅拌。 绝不能 把 水倒入浓硫酸里 。因 为 浓硫酸密 度 比 水大,而 且 溶于水放出大量的热 ,如 果 把 水倒入浓硫酸中,水浮 在 浓硫酸之 上 ,造 成局 部 沸 腾 。 (5)其 他 常见的酸:硝 酸(HNO3)、醋 酸(CH3COOH) 2.酸的化学性质(酸具 有相 似 的化学性质是因 为 酸溶液中都 含 有 H+) 酸 → H+ + 酸根离子 酸的化学性质 实验现象 化学方程式 1.酸跟指示剂反应 使紫色石蕊试液变红色, 无色酚酞试液不变色(无色) 2.酸和活泼金属反应生成盐和氢气 有气泡冒出,固体逐渐溶解 Mg + 2HCl = MgCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑ 有气泡冒出,固体逐渐溶解 Zn + 2HCl = Zn Cl2 + H2↑ Zn + H2SO4 = Zn SO4 + H2↑ 有气泡冒出,固体逐渐溶解, 溶液由无色变成浅绿色 Fe + 2HCl = FeCl2 + H2↑ Fe + H2SO4 = FeSO4 + H2↑ - 2 - 3. 酸 和 金 属 氧 化 物反 应 生 成 盐 和 水 固 体 逐 渐 溶 解 , 溶 液 由 无 色 变 成 黄 色 Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 固 体 逐 渐 溶 解 , 溶 液 由 无 色 变 成 蓝 色 Cu O + 2HCl = Cu Cl2 + H2O Cu O + H2SO4 = Cu SO4 + H2O 4. 酸 和 碱 反 应 生 成盐 和 水 ( 中 和 反 应 ) NaOH + HCl = NaCl + H2O...