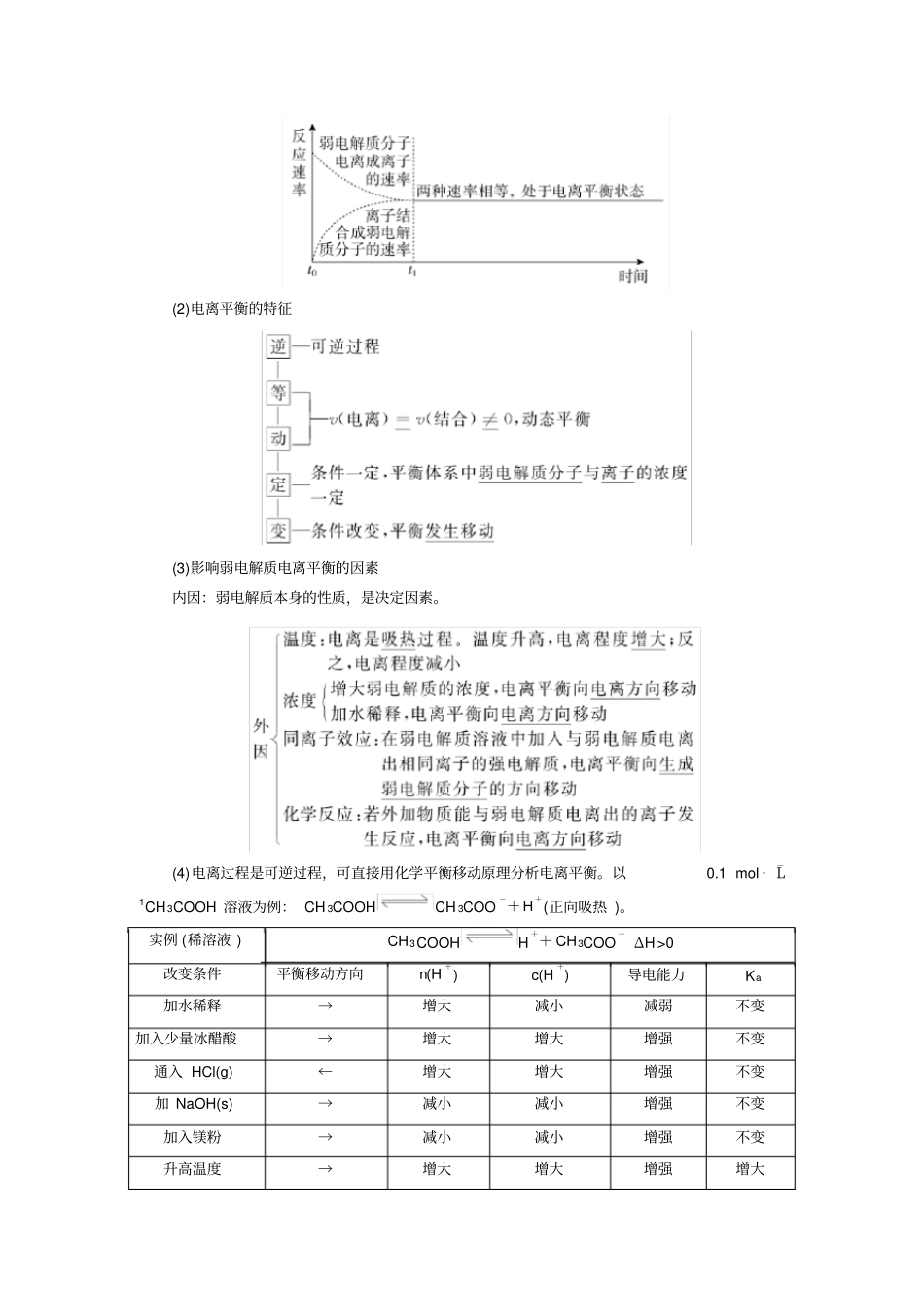
一、弱电解质的电离1、定义:电解质: 在 水溶液 中或熔化状态 下自身能够 电离 出自由移动离子 的化合物 ,叫电解质。非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子的化合物。概念理解:①电解质、非电解质都是化合物,能导电的物质可能是溶液(混合物)、金属(单质),但他们不属于电解质非电解质的研究对象,因此他们既不是电解质也不是非电解质;②自身电离: SO2、NH3、CO2、等化合物能和水反应形成酸或碱,但发生电离的并不是他们本身吗,因此属于非电解质;③只能在水中发生电离的电解质有酸或者某些易溶于水高温下易分解的盐,如液态氯化氢是化合物,只存在分子, 没有发生电离, 因此不能导电, 又如 NaHCO3在高温时即分解,不能通过熔融态证明其为电解质;只能在熔融状态下电离的电解质是活泼金属氧化物,如Na2O、 CaO,他们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明;既能在水溶液中又能在溶液中发生电离的物质是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BaSO 4。④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子;⑤是电解质,但是要产生离子也要在溶液状态或者熔融状态,否则即便存在离子也无法导电,比如NaCl,晶体状态不能导电。⑥电解质的强弱与导电性、溶解性无关。如如BaSO4 不溶于水,但溶于水的BaSO4 全部电离, 故 BaSO4 为强电解质。导电性与自由移动离子的浓度和带电荷数等有关。强电解质:在水溶液里 全部电离 成离子的电解质。弱电解质:在水溶液里只有一部分电离 成离子的电解质。2.常见的电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见分类:3、电离方程式的书写—— “强等号,弱可逆,多元弱酸分步离”①强电解质:如H 2SO4:H2SO4===2H++SO2-4。②弱电解质a.一元弱酸,如CH 3COOH :CH3COOHCH 3COO-+H+。b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步的电离程度,如H2CO 3: H2CO3H++HCO-3 、 HCO-3H++CO 2-3。原因是上一级电离出的H+是下一级电离的产物,对下一级电离电离有抑制作用c.多元弱碱,虽然分布电离,但是书写时一步到位。如Fe(OH) 3:Fe(OH) 3Fe3++3OH-。③酸式盐a.强酸的酸式盐b.弱酸的酸式盐: “强中有弱”, 如 NaHCO 3:NaHCO 3===Na++HCO-3 、HCO-3H++CO2-3。4.弱电解质的电...