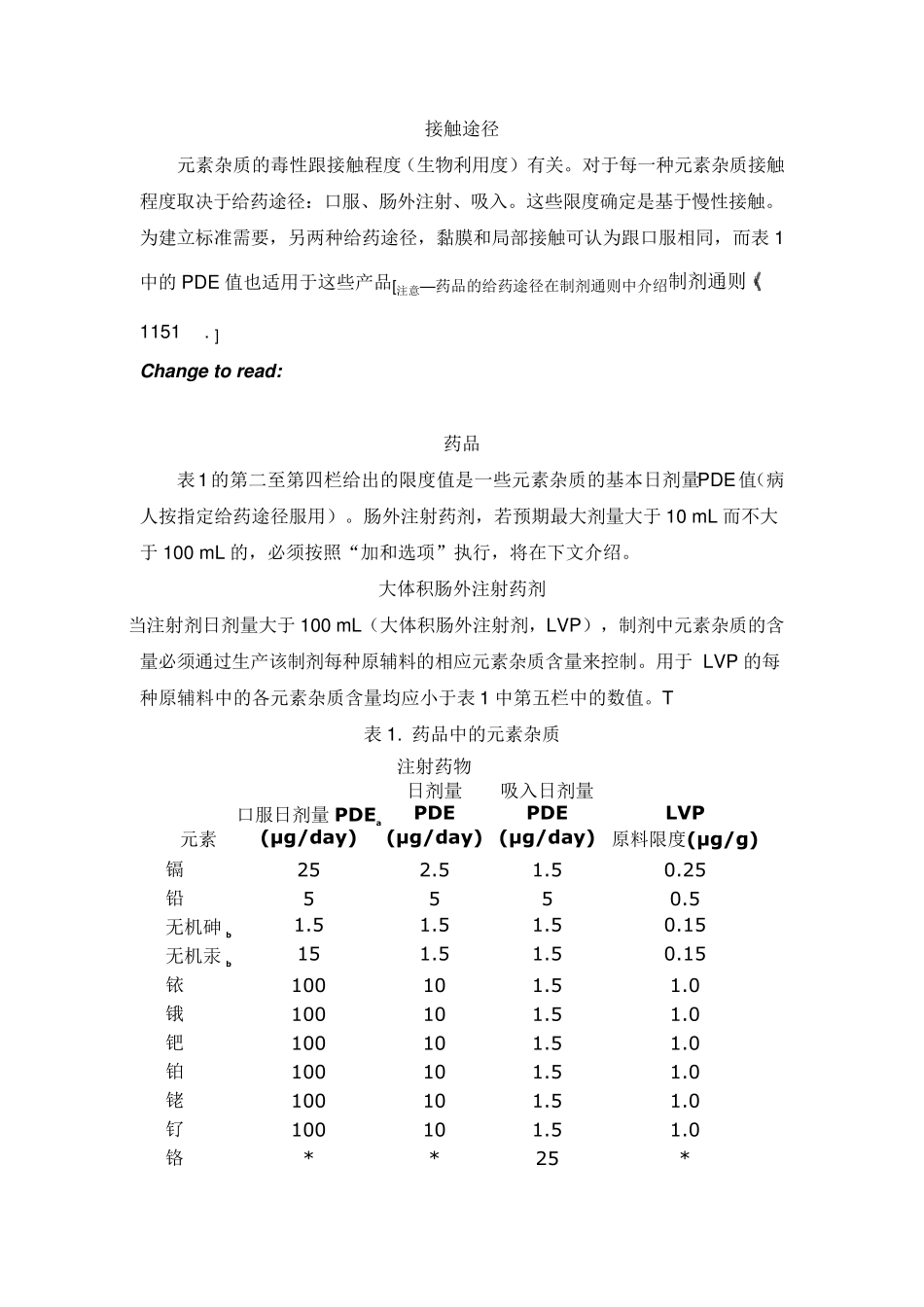
2 3 2 元素杂质—限度 介绍 本通则明确了药品中各元素杂质的限度。元素杂质包括催化剂、环境污染物,可能存在于原料药、赋形剂、制剂中。这些杂质或自然产生,或有意添加,或由于不注意而引入(例如,与处理设备相互作用)。当知道元素杂质存在,或有意添加,或有引入的可能性,应当保证这些杂质符合限度要求。可以采用基于风险的控制策略来确保产品满足限度标准。由于砷、镉、铅和汞普遍存在的特性,风险控制策略至少应考虑这四种元素。不管采用什么分析方法,所有药品均应满足元素杂质限度标准。 本章提出的限度标准不适用于赋形剂与原料药,除非本章或各论中明确说明。然而赋形剂与原料药中元素杂质水平必须报告。 本章提出的限度标准同样不适用于兽用产品和常规疫苗。饮食补充剂和它们的成份的相关规定见于《饮食补充剂中的元素杂质》 2 2 3 2 .1 形态分析 对于元素氧化态、有机络合态、化合态的测定,称为形态分析。每种元素可能存在不同的氧化态或络合态。然而,砷和汞应特别关注,因为它们的无机态和络合有机态具有不同的毒性。 砷的限度标准是基于无机态(毒性最大)。假定样品中所有砷都是无机态,可用总砷测定法检测。当总砷法结果超过限度标准,应当使用能够对不同形态砷定量的分析方法,以确定无机态砷是否满足法定要求。 汞的限度标准是基于无机(2+)氧化态。甲基汞(毒性最强),但对于药品,通常不是问题。这样,汞限度标准的确定是基于汞最常见的无机形态。对于可能含有甲基汞的产品(例如,从鱼中得到的物质),相应的汞限度标准将在各论中提及。 接触途径 元素杂质的毒性跟接触程度(生物利用度)有关。对于每一种元素杂质接触程度取决于给药途径:口服、肠外注射、吸入。这些限度确定是基于慢性接触。为建立标准需要,另两种给药途径,黏膜和局部接触可认为跟口服相同,而表1中的PDE 值也适用于这些产品[注意—药品的给药途径在制剂通则中介绍制剂通则 1151 . ] Change to read: 药品 表1的第二至第四栏给出的限度值是一些元素杂质的基本日剂量PDE值(病人按指定给药途径服用)。肠外注射药剂,若预期最大剂量大于10 m L 而不大于100 m L 的,必须按照“加和选项”执行,将在下文介绍。 大体积肠外注射药剂 当注射剂日剂量大于100 m L(大体积肠外注射剂,LVP),制剂中元素杂质的含量必须通过生产该制剂每种原辅料的相应元素杂质含量来控制。用于LVP 的每种原辅料中的各元素杂质含量均...