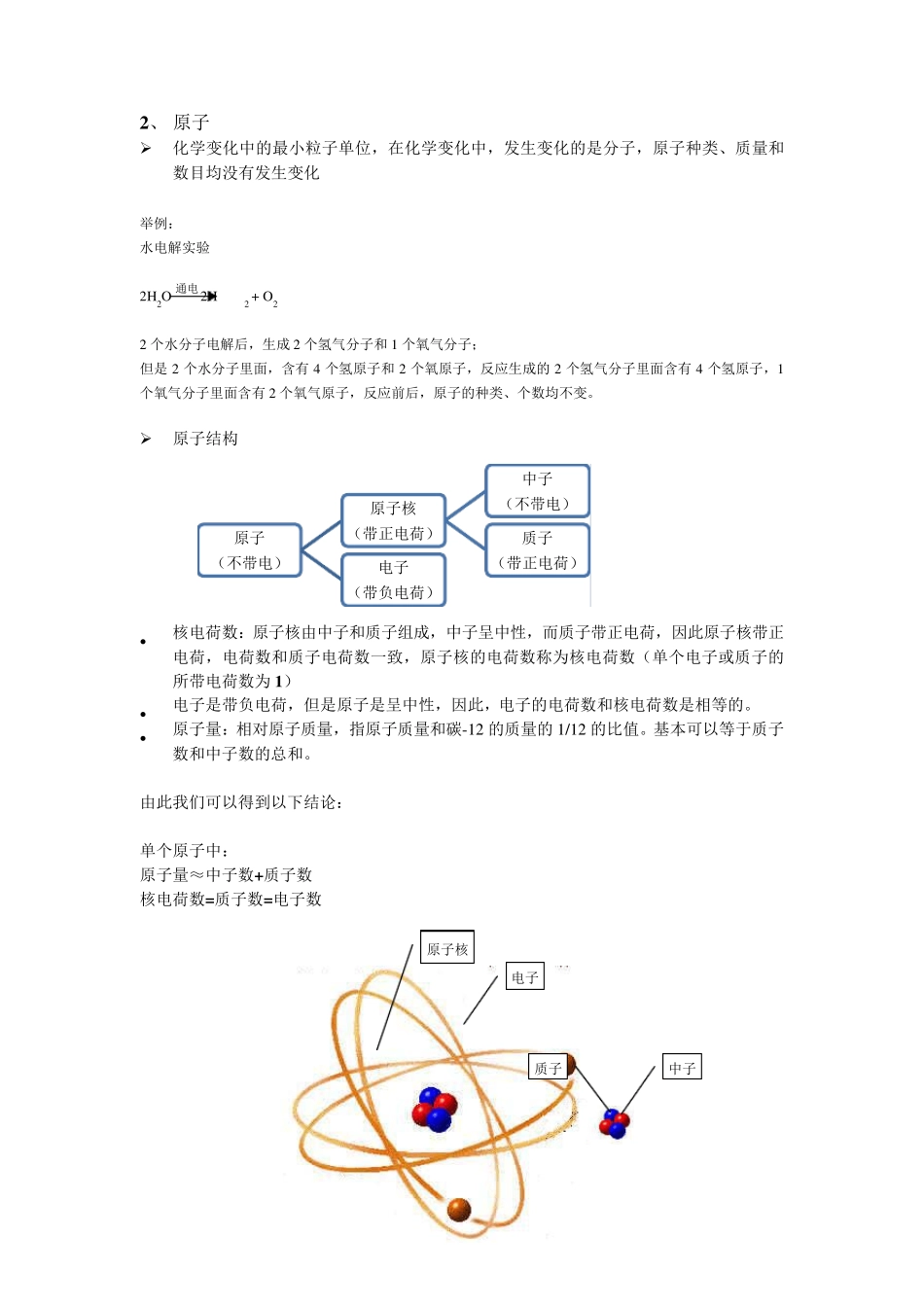
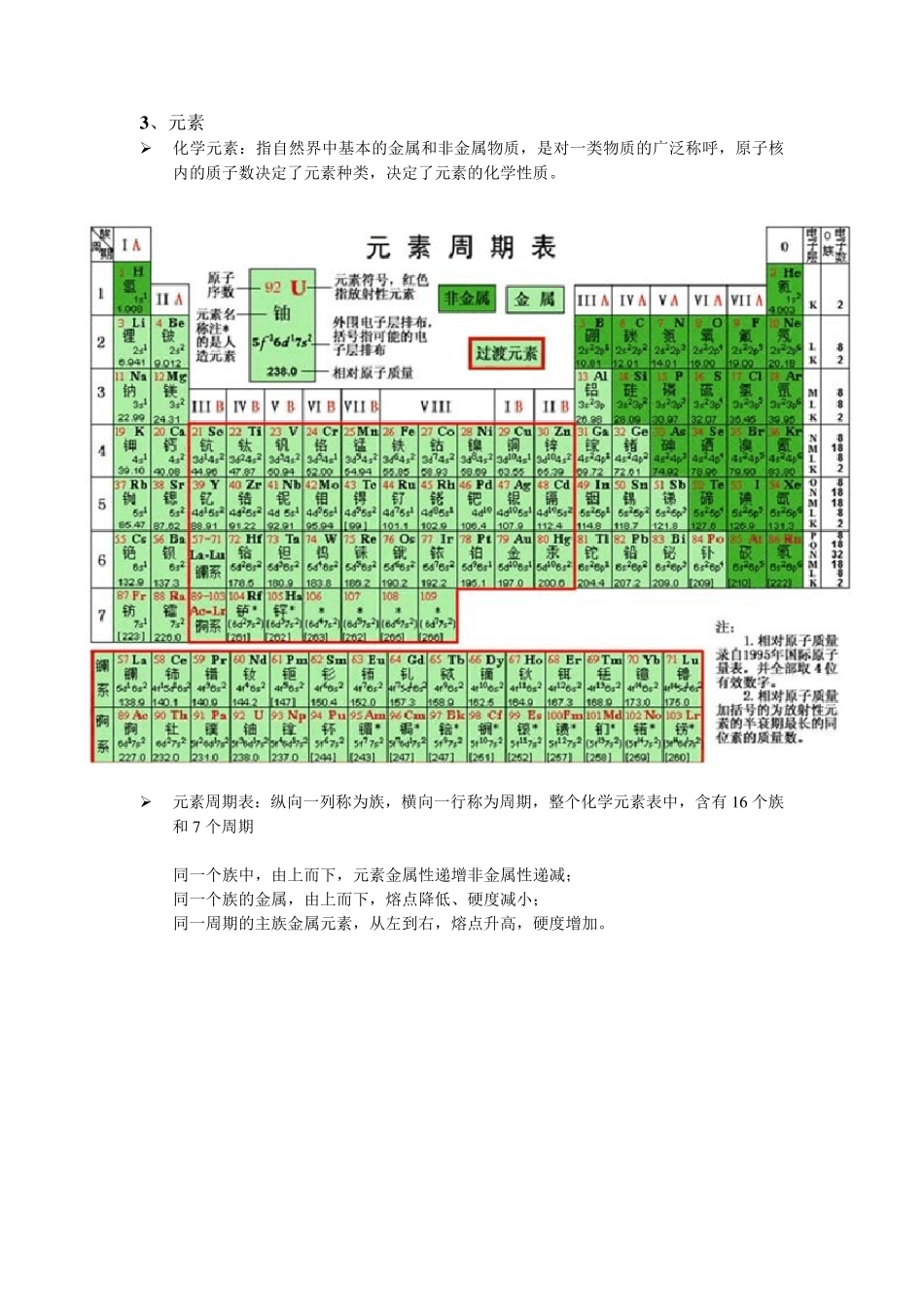
物质结构篇 1 、 分子 是能单独存在的,保持化学性能的最小单位,是物质组成的基本单位名称。 举例: 水 H2O 最小存在单位为 一个水分子 氧气 O2 最小存在单位为 一个氧气分子 碳酸钙 CaCO3 最小单位为 一个碳酸钙分子 同种分子物质的化学性质相同,不同种分子物质的化学性能不同 举例: 水和冰的化学式都为 H2O,虽然在物理形态上不同,一个为液体一个为固体,但是它们的化学性质是一样的。 通电 2、 原子 化学变化中的最小粒子单位,在化学变化中,发生变化的是分子,原子种类、质量和数目均没有发生变化 举例: 水电解实验 2H 2O 2H2 + O 2 2 个水分子电解后,生成2 个氢气分子和1 个氧气分子; 但是2 个水分子里面,含有4 个氢原子和2 个氧原子,反应生成的2 个氢气分子里面含有4 个氢原子,1个氧气分子里面含有2 个氧气原子,反应前后,原子的种类、个数均不变。 原子结构 核电荷数:原子核由中子和质子组成,中子呈中性,而质子带正电荷,因此原子核带正电荷,电荷数和质子电荷数一致,原子核的电荷数称为核电荷数(单个电子或质子的所带电荷数为1) 电子是带负电荷,但是原子是呈中性,因此,电子的电荷数和核电荷数是相等的。 原子量:相对原子质量,指原子质量和碳-12 的质量的1/12 的比值。基本可以等于质子数和中子数的总和。 由此我们可以得到以下结论: 单个原子中: 原子量≈中子数+质子数 核电荷数=质子数=电子数 原子(不带电)原子核(带正电荷)中子(不带电)质子(带正电荷)电子(带负电荷)电子 原子核 中子 质子 3 、元素 化学元素:指自然界中基本的金属和非金属物质,是对一类物质的广泛称呼,原子核内的质子数决定了元素种类,决定了元素的化学性质。 元素周期表:纵向一列称为族,横向一行称为周期,整个化学元素表中,含有 1 6 个族和 7 个周期 同一个族中,由上而下,元素金属性递增非金属性递减; 同一个族的金属,由上而下,熔点降低、硬度减小; 同一周期的主族金属元素,从左到右,熔点升高,硬度增加。 4 、质子和中子 质子和中子都是原子核的组成部分。原子核中的质子数目,决定了它的化学性质和化学元素。 中子存在的意义:所有的质子都是带正电,如果没有中子的存在,质子和质子之间的相互斥力会使得质子和质子无法形成原子核,无法形成除了氢以外的元素,只有中子存在的相互作用,...