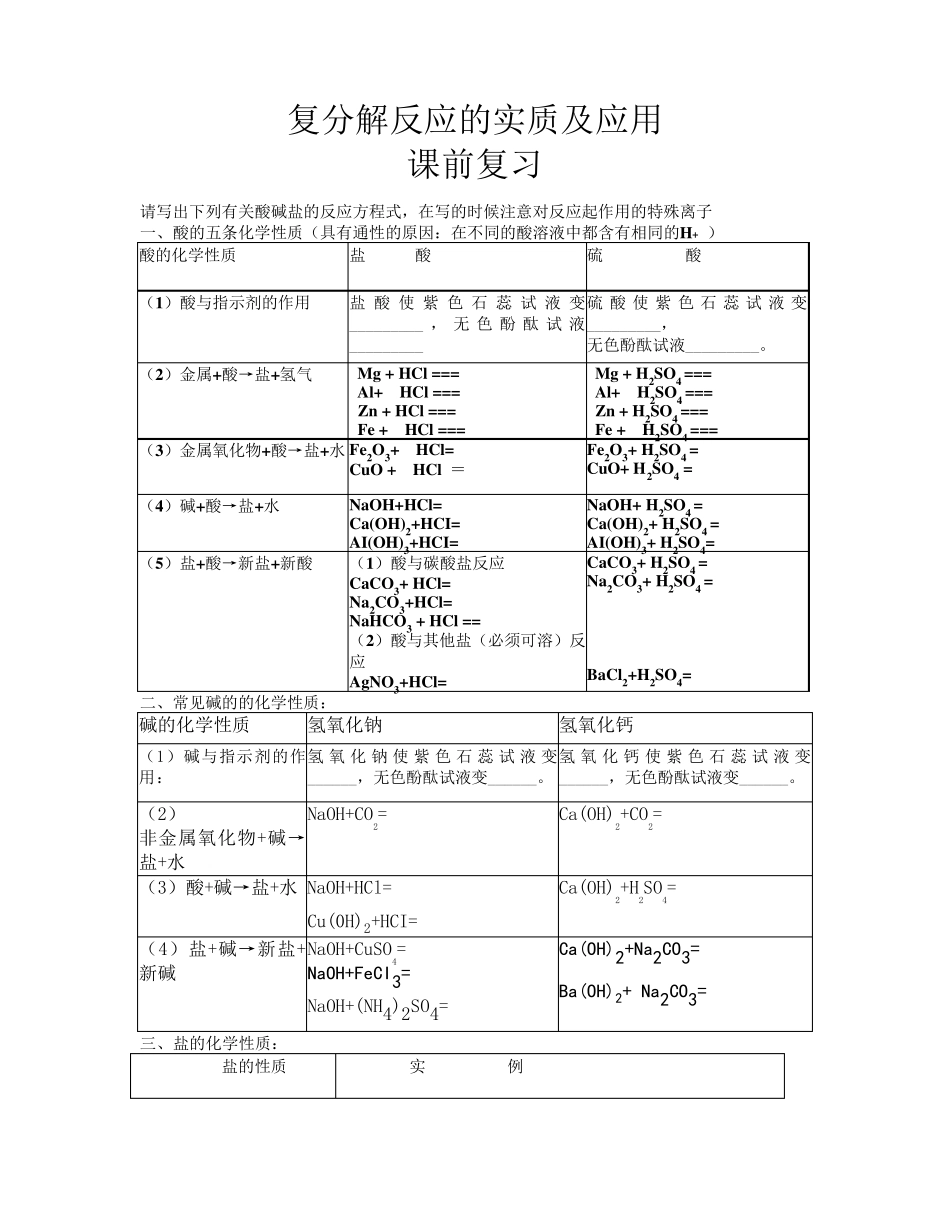
复分解反应的实质及应用 课前复习 请写出下列有关酸碱盐的反应方程式,在写的时候注意对反应起作用的特殊离子 一、酸的五条化学性质(具有通性的原因:在不同的酸溶液中都含有相同的H+ ) 酸的化学性质 盐 酸 硫 酸 (1)酸与指示剂的作用 盐酸使紫色石蕊试液变_________ ,无色酚酞试液_________ 硫酸使紫色石蕊试液变_________, 无色酚酞试液_________。 (2)金属+酸→盐+氢气 Mg + HCl === Al+ HCl === Zn + HCl === Fe + HCl === Mg + H2SO4 === Al+ H2SO4 === Zn + H2SO4 === Fe + H2SO4 === (3)金属氧化物+酸→盐+水 Fe2O3+ HCl= Cu O + HCl = Fe2O3+ H2SO4 = Cu O+ H2SO4 = (4)碱+酸→盐+水 NaOH+HCl= Ca(OH)2+HCI= AI(OH)3+HCI= NaOH+ H2SO4 = Ca(OH)2+ H2SO4 = AI(OH)3+ H2SO4= (5)盐+酸→新盐+新酸 (1)酸与碳酸盐反应 CaCO3+ HCl= Na2CO3+HCl= NaHCO3 + HCl == (2)酸与其他盐(必须可溶)反应 AgNO3+HCl= CaCO3+ H2SO4 = Na2CO3+ H2SO4 = BaCl2+H2SO4= 二、常见碱的的化学性质: 碱的化学性质 氢氧化钠 氢氧化钙 (1)碱与指示剂的作用: 氢 氧 化钠 使紫色石蕊试液变______,无色酚酞试液变______。 氢 氧 化钙 使紫色石蕊试液变______,无色酚酞试液变______。 (2) 非金属氧化物+碱→盐+水 NaOH+CO2= Ca(OH)2+CO2= (3)酸+碱→盐+水 NaOH+HCl= Cu(0H)2+HCI= Ca(OH)2+H2SO4= (4)盐+碱→新盐+新碱 NaOH+CuSO4= NaOH+FeCI3= NaOH+(NH4)2SO4= Ca(OH)2+Na2CO3= Ba(OH)2+ Na2CO3= 三、盐的化学性质: 盐的性质 实 例 盐+金属→新盐+新金属 CuSO4+Fe= 盐+酸→新盐+新酸 BaCl2+H2SO4 = 盐 +碱 →新盐+新碱 NaOH+ (NH4)2SO4 = 盐 +盐 →两种新盐 AgNO3+NaCl = Na2SO4 + BaCl2 = 课后提升 1.(2013·长沙)下列各组物质分别加入到足量的水中,能得到无色透明溶液的是( ) A.KNO3 NaCl HCl B.FeCl3 Na2SO4 KCl C.CuSO4 H2SO4 NaCl D.FeCl2 KCl NaOH 2.下列物质在水溶液中能大量共存的是( ) A.HCl、Ca(OH)2、NaNO3 B.NaCl、K2CO3、H2SO4 C.HCl、BaCl2、CuSO4 D.KNO3、NaOH、Na2CO3 3.(2012• 苏州)能大量共存且形成无色溶液的一组离子是( ) A.Cu2+、SO42﹣、H+ B.CI﹣、NH4+、OH﹣ C.Ba2+、SO42﹣、NO3﹣ D.Na+、K+、NO3﹣ ...