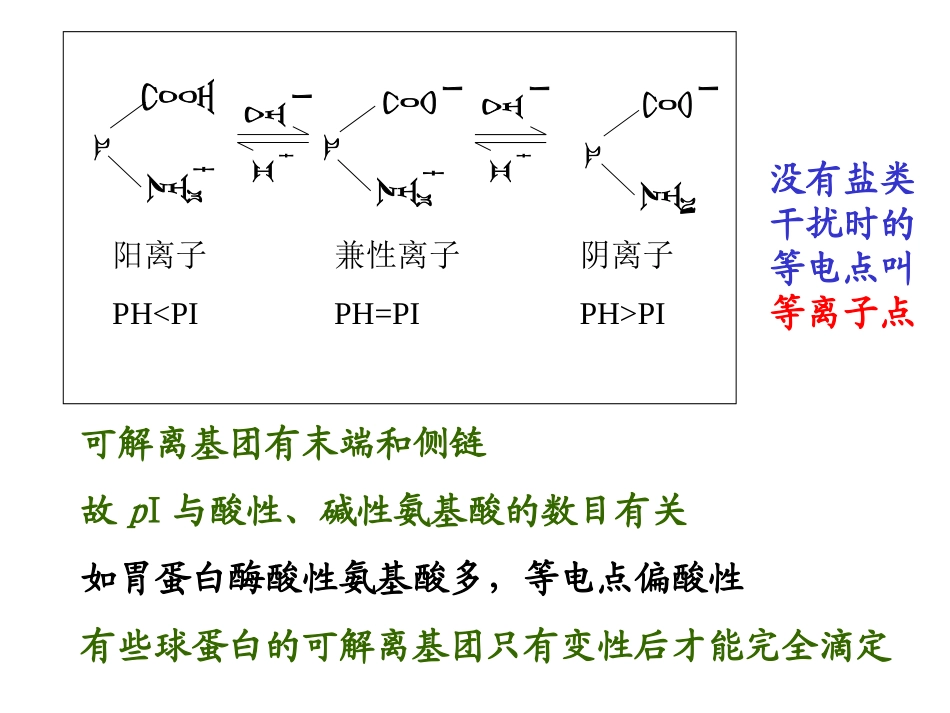
第三章蛋白质的通性、纯化与表征1、蛋白质的理化性质:酸碱性质、胶体性质与沉淀、变性、颜色反应2、分离纯化的方法:盐析、电泳、等电聚焦、层析等3、表征:活力、比活力蛋白质与多肽一样,能够发生两性离解,也有等电点。在等电点时,蛋白质的溶解度最小,在电场中不移动。在不同的pH环境下,蛋白质的电学性质不同。在等电点偏酸性溶液中,蛋白质粒子带正电荷,在电场中向负极移动;在等电点偏碱性溶液中,蛋白质粒子带负电荷,在电场中向正极移动。这种现象称为蛋白质电泳1、酸碱性质阳离子PH
PI兼性离子PH=PI可解离基团有末端和侧链故pI与酸性、碱性氨基酸的数目有关如胃蛋白酶酸性氨基酸多,等电点偏酸性有些球蛋白的可解离基团只有变性后才能完全滴定没有盐类干扰时的等电点叫等离子点蛋白质分子的颗粒直径已达1-100nm,处于胶体颗粒的范围。因此,蛋白质具有亲水溶胶的性质。由于胶体溶液中的蛋白质不能通过半透膜,因此可以应用透析法将非蛋白的小分子杂质除去。22、蛋白质的胶体性质:、蛋白质的胶体性质:蛋白质的胶体性质布郎运动、丁道尔现象、电泳现象,不能透过半透膜,具有吸附能力蛋白质溶液稳定的原因:1)表面形成水膜(水化层);2)带相同电荷。3)大小为1-100nm的胶体颗粒++++++蛋白质胶体溶液的稳定性与它的分子量大小、所带的电荷和水化作用有关。改变溶液的条件,将影响蛋白质的溶解性质在适当的条件下,蛋白质能够从溶液中沉淀出来。蛋白质的沉淀作用蛋白质的沉淀作用1.加高浓度盐类(盐析):加盐使蛋白质沉淀析出。2.分段盐析:调节盐浓度,可使混合蛋白质溶液中的几种蛋白质分段析出。血清球蛋白(50%(NH4)2SO4饱和度),清蛋白(饱和(NH4)2SO4)。2.加有机溶剂3.加重金属盐4.加生物碱试剂单宁酸、苦味酸、钼酸、钨酸、三氯乙酸能沉淀生物碱,称生物碱试剂。在温和条件下,通过改变溶液的pH或电荷状况,使蛋白质从胶体溶液中沉淀分离。在沉淀过程中,结构和性质都没有发生变化,在适当的条件下,可以重新溶解形成溶液,所以这种沉淀又称为非变性沉淀。可逆沉淀是分离和纯化蛋白质的基本方法,如等电点沉淀法、盐析法和条件有机溶剂沉淀法等。可逆沉淀可逆沉淀在强烈沉淀条件下,不仅破坏了蛋白质胶体溶液的稳定性,而且也破坏了蛋白质的结构和性质,产生的蛋白质沉淀不可能再重新溶解于水。由于沉淀过程发生了蛋白质的结构和性质的变化,所以又称为变性沉淀。如加热沉淀、强酸碱沉淀、常温有机溶剂、重金属盐沉淀和生物碱沉淀等都属于不可逆沉淀。不可逆沉淀不可逆沉淀一、蛋白质在某些理化因素的作用下,其空间结构受到破坏,从而改变其理化性质,并失去其生物活性,称为蛋白质的变性。二、变性的实质是破坏了蛋白质的空间结构,并不引起一级结构的改变。蛋白质的变性三、蛋白质的变性通常都伴随着不可逆沉淀,但沉淀的蛋白质不一定都变性后的蛋白质。四、加热使蛋白质变性并凝聚成块状称为凝固。因此,凡凝固的蛋白质一定发生变性。反应名称试剂颜色反应有关基团有此反应的蛋白质或氨基酸双缩脲反应NaOH、CuSO2紫色或粉红色二个以上肽键所有蛋白质米伦反应HgNO3、Hg(NO3)2及HNO3混合物红色Tyr黄色反应浓HNO3及NH3黄色、橘色Tyr、Phe乙醛酸反应(Hopking-Cole反应)乙醛酸试剂及浓H2SO4紫色Trp坂口反应(Sakaguchi反应)α-萘酚、NaClO红色胍基Arg酚试剂反应(Folin-Cioculteu反应)碱性CuSO4及磷钨酸-钼酸蓝色酚基、吲哚基Tyr茚三酮反应茚三酮蓝色自由氨基及羧基α-氨基酸4、蛋白质的颜色反应:鉴定蛋白质的量—OHN•大部分蛋白质均含有带芳香环的苯丙氨酸、酪氨酸和色氨酸。•这三种氨基酸的在280nm附近有最大吸收。因此,大多数蛋白质在280nm附近显示强的吸收。•利用这个性质,可以对蛋白质进行定性鉴定。•初步定量,若精细定量用考马斯亮蓝染色55、蛋白质的紫外吸收、蛋白质的紫外吸收分离纯化之前保证蛋白质一定的纯度依据:大小、形状、溶解度、酸碱性、吸附性及对配体的亲和性若要研究蛋白质的功能则要求高级结构完整难度大,迄今几百个蛋白质的单晶(单晶的天然结构都没有发生变化)蛋白质的分离与纯化方法蛋白质的分离与纯化方法(一)...