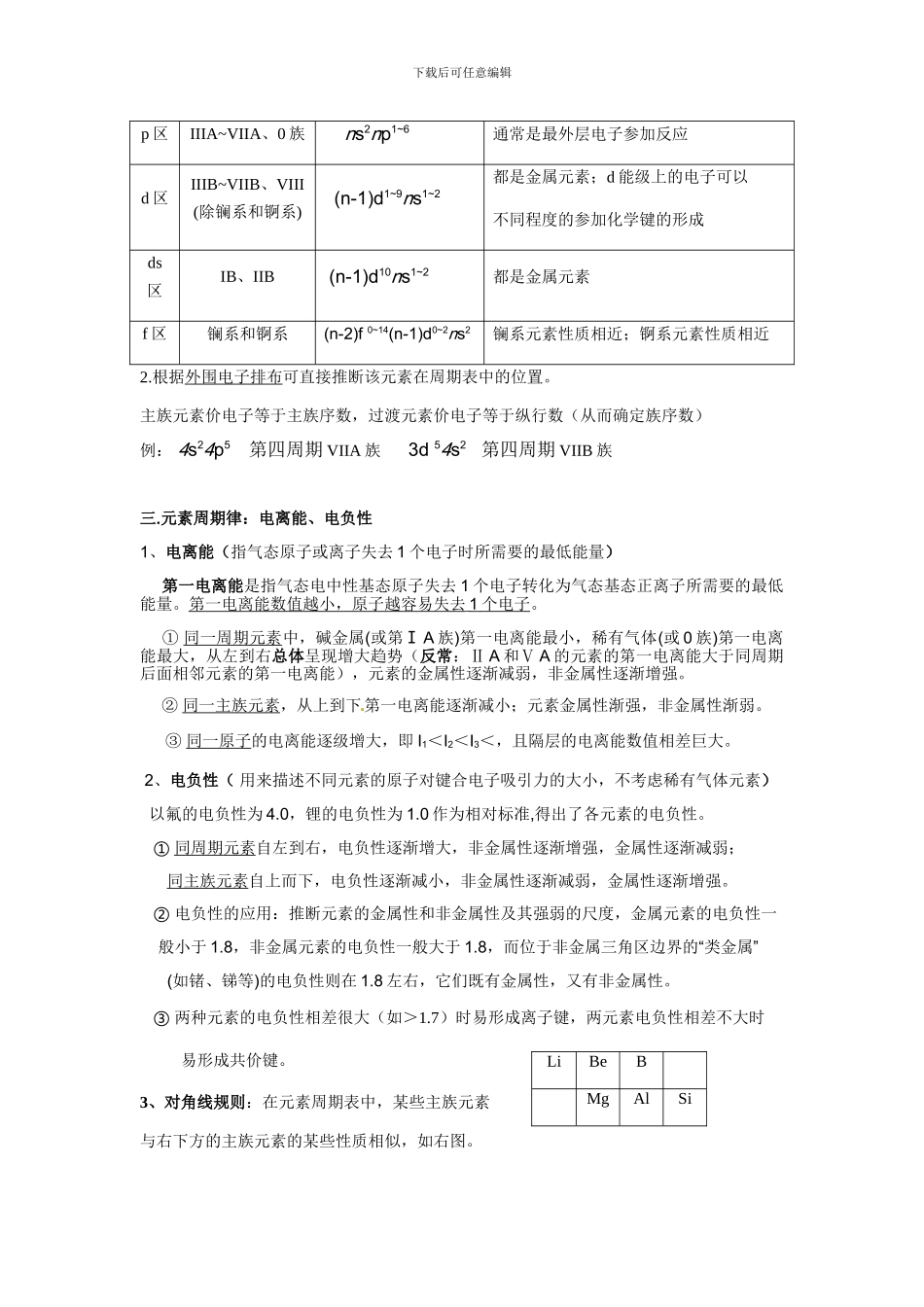
下载后可任意编辑第一章 原子结构与性质一.原子结构 1.能级与能层 注意: 每个能层的能级种数为 n; 轨道总数为 n2 ; 每个轨道最多容纳电子数为 2 每个能层最多容纳电子数为 2n2 2.原子轨道:不同能级上的电子出现概率约为 90%的电子云空间轮廓图称为原子轨道 3.原子核外电子排布规律 ⑴ 构造原理:随着核电荷数递增,大多数元素的电中性基 态原子的电子按能量由低到高的顺序填入核外电子运动轨道(能级),叫做构造原理。 1s / 2s 2p / 3s 3p / 4s 3d 4p / 5s 4d 5p / 6s 4f 5d 6p / 7s 5f 6d 7p 能级交错:原子轨道的能量关系是:ns<(n-2)f<(n-1)d<np 【能级组:ns (n-2)f (n-1)d np;一个能级组中的各能级能量相近但不同】(2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状 态,简称能量最低原理。 基态原子:处于最低能量状态的原子 激发态原子:处于能量较高状态的原子基态原子可以吸收能量使核外电子跃迁到较高能级变成激发态,形成吸收光谱激发态原子也可释放能量使核外电子跃迁到较低能级变成低能激发态或基态,形成发射光谱下载后可任意编辑现代化学中常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析(焰火、激光、灯光、霓虹灯光、焰色反应等许多可见光都与核外电子跃迁 释放能量有关)(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在 4 个量子数完全相同的电子。换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利原理。(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特规则。比如,p3的轨道式为 或 ,而不是 洪特规则特例:当 p、d 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即 p0、d0、p3、d5、p6、d10时,是较稳定状态。前 36 号元素全空状态的有 4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3 、 15P 3s23p3 、 24Cr 3d54s1 、 25Mn 3d54s2 、 33As 4s24p3 ; 全 充 满 状 态 的 有 10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。4. 基态原子核外电子排布的表示方法 (1) 电子排布式: ① 用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,...