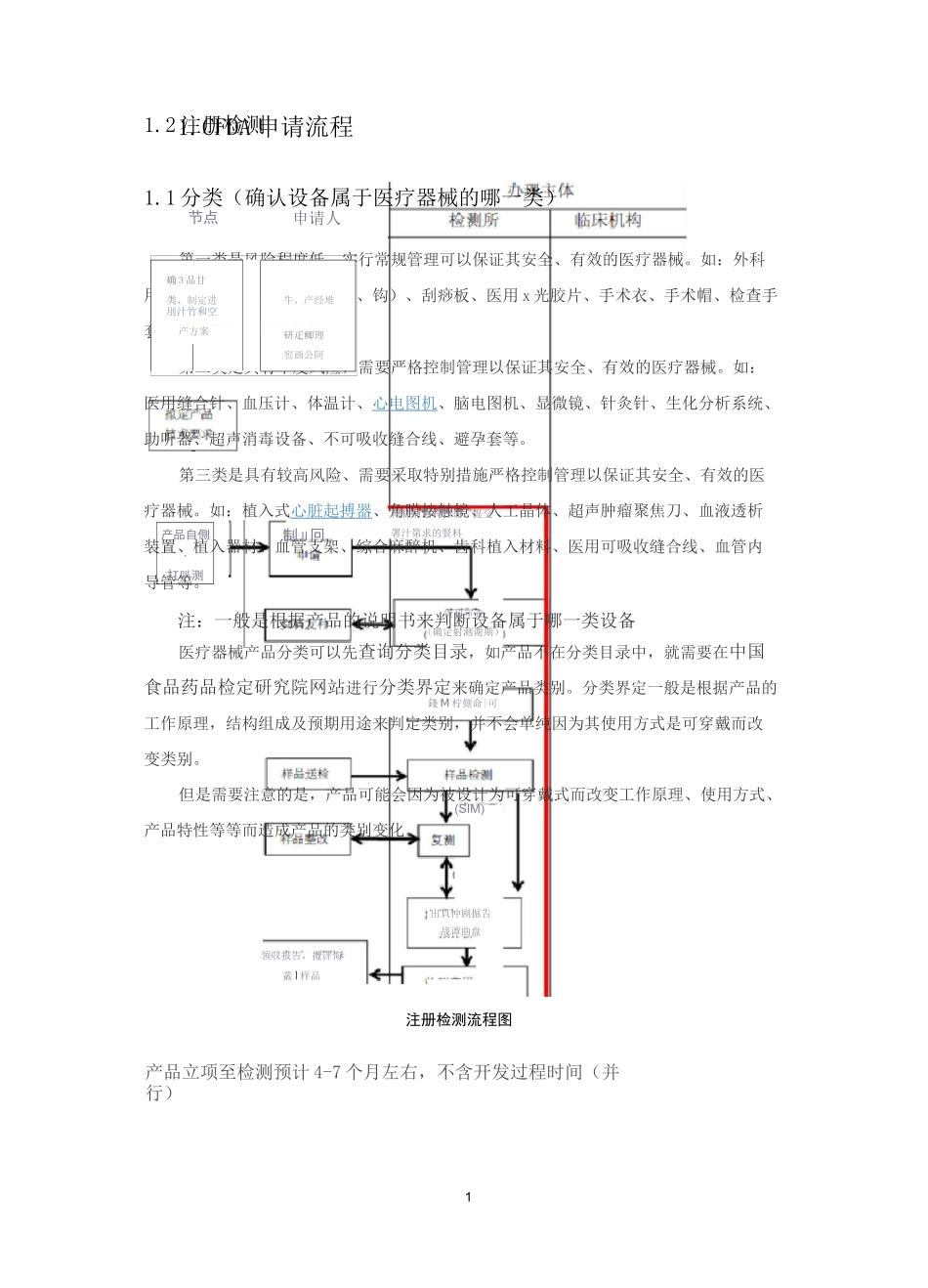
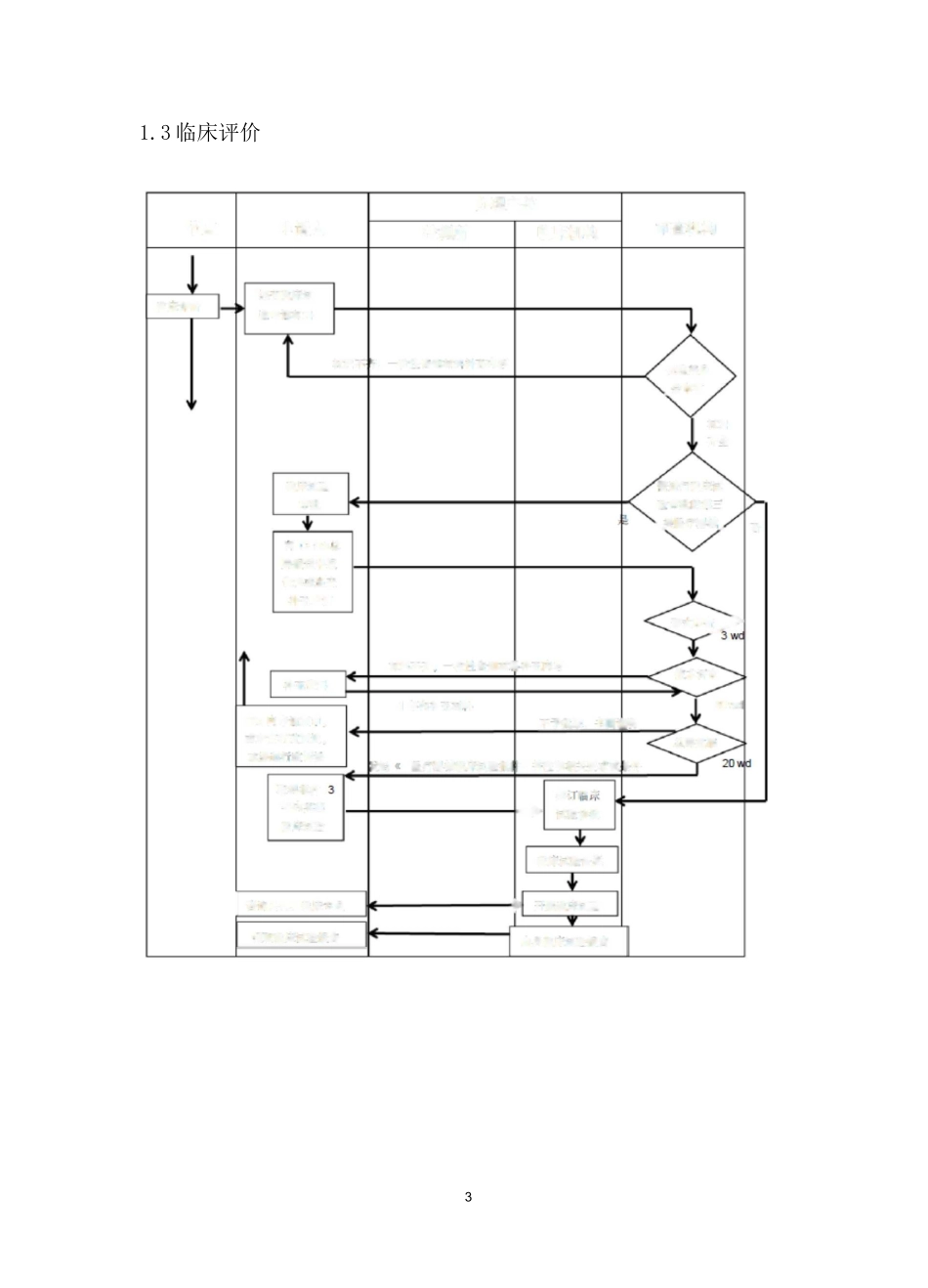
11.CFDA 申请流程1.1 分类(确认设备属于医疗器械的哪一类)第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。如:外科用手术器械(刀、剪、钳、镊、钩)、刮痧板、医用 x 光胶片、手术衣、手术帽、检查手套、纱布绷带、引流袋等。第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。如:医用缝合针、血压计、体温计、心电图机、脑电图机、显微镜、针灸针、生化分析系统、助听器、超声消毒设备、不可吸收缝合线、避孕套等。第三类是具有较高风险、需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。如:植入式心脏起搏器、角膜接触镜、人工晶体、超声肿瘤聚焦刀、血液透析装置、植入器材、血管支架、综合麻醉机、齿科植入材料、医用可吸收缝合线、血管内导管等。注:一般是根据产品的说明书来判断设备属于哪一类设备医疗器械产品分类可以先查询分类目录,如产品不在分类目录中,就需要在中国食品药品检定研究院网站进行分类界定来确定产品类别。分类界定一般是根据产品的工作原理,结构组成及预期用途来判定类别,并不会单纯因为其使用方式是可穿戴而改变类别。但是需要注意的是,产品可能会因为被设计为可穿戴式而改变工作原理、使用方式、产品特性等等而造成产品的类别变化。1.2 注册检测节点确 3 品甘类、制定进牛,产经堆刖汁竹和空产方案研疋鲫理窖画公阿产品自側・扛叭测申请人錢 M 柠側命|可领収报告,攬评悔叢 I 样品制 II冋问林前恻利曹训:提交署汁第求的賢料資科审查〔确定射测谢期)(SIM)出貝忡剧掘告战谭曲盘注册检测流程图产品立项至检测预计 4-7 个月左右,不含开发过程时间(并行)2I否校术评总同批伦理耍址、金m杯氐得批艸年内实施|卜床觴需进行临床试齡■审批的第:.发医疔器腊式审电/■节临床评申请审查机办理主I 舒询聲司.临床专员轴収临床阳貝临沐区唆报告检测临床机林料不阳,牧忡告知•林料朴充内容壬;.|:2M 内申有亘审,城申请行域產佻成温足 f.谀诉耻轿料不齐.放杵告知■材圳朴充内弈40w1 讦内卄充材也迤虹」童明朴充资谜医疔器[a]CFDA.^局报送吊世瓷料媲交补充申请覗交临从讫临城述岭H>UX 询说恥沐址龄备调卄屈曲床议歧31.3 临床评价4临床流程图临床预计 6 个月以上 1 年左右,视产品而定。申请免于临床试验、通过同品种医疗器械临床试验获得的数据或者开展临床试验。需要注意的是,对于想要申请免临床的产品,即使满足了免临床目录中的要求,还...