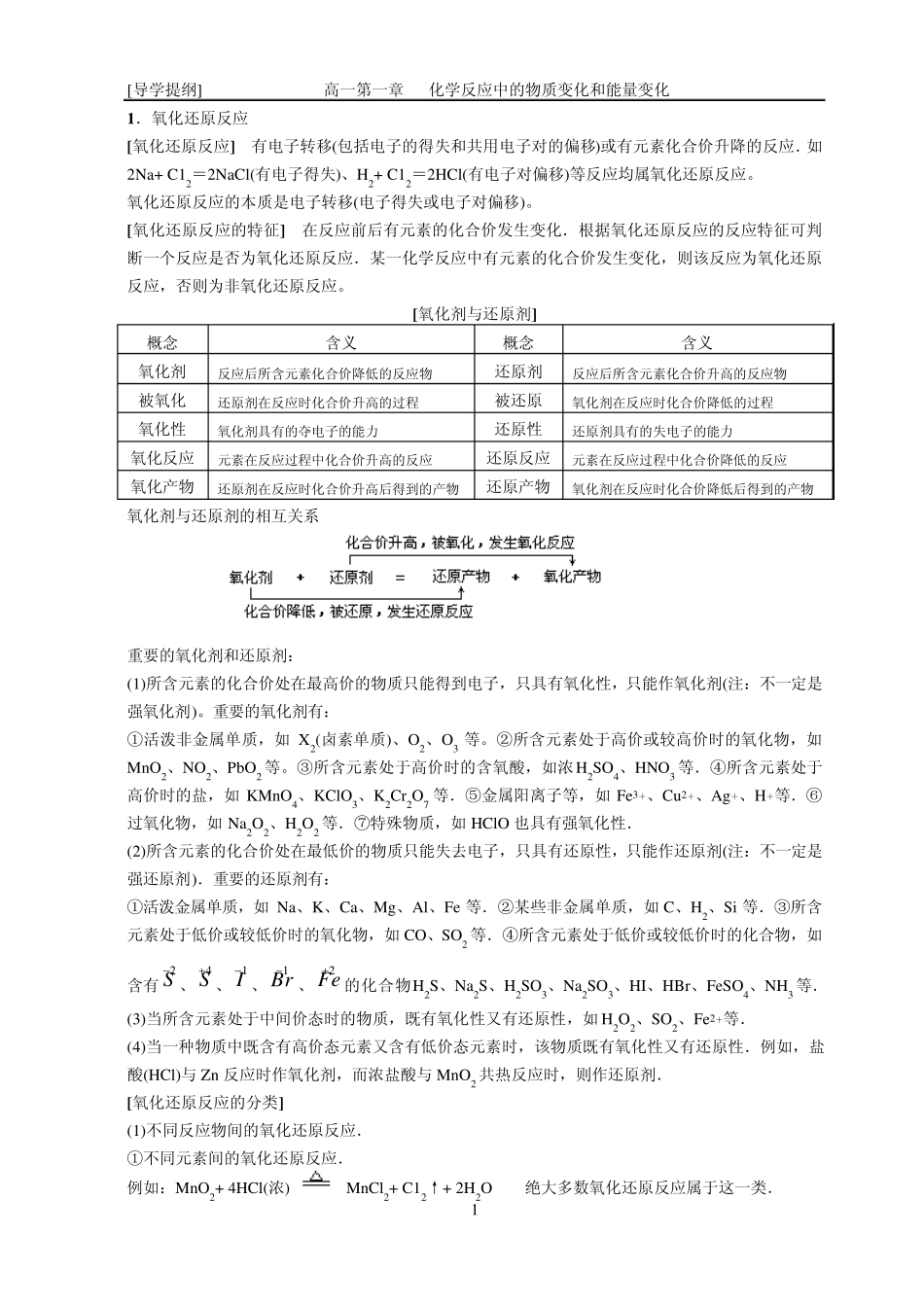
[导学提纲] 高一第一章 化学反应中的物质变化和能量变化 1 1.氧化还原反应 [氧化还原反应] 有电子转移(包括电子的得失和共用电子对的偏移)或有元素化合价升降的反应.如2Na+ C12=2NaCl(有电子得失)、H2+ C12=2HCl(有电子对偏移)等反应均属氧化还原反应。 氧化还原反应的本质是电子转移(电子得失或电子对偏移)。 [氧化还原反应的特征] 在反应前后有元素的化合价发生变化.根据氧化还原反应的反应特征可判断一个反应是否为氧化还原反应.某一化学反应中有元素的化合价发生变化,则该反应为氧化还原反应,否则为非氧化还原反应。 [氧化剂与还原剂] 概念 含义 概念 含义 氧化剂 反应后所含元素化合价降低的反应物 还原剂 反应后所含元素化合价升高的反应物 被氧化 还原剂在反应时化合价升高的过程 被还原 氧化剂在反应时化合价降低的过程 氧化性 氧化剂具有的夺电子的能力 还原性 还原剂具有的失电子的能力 氧化反应 元素在反应过程中化合价升高的反应 还原反应 元素在反应过程中化合价降低的反应 氧化产物 还原剂在反应时化合价升高后得到的产物 还原产物 氧化剂在反应时化合价降低后得到的产物 氧化剂与还原剂的相互关系 重要的氧化剂和还原剂: (1)所含元素的化合价处在最高价的物质只能得到电子,只具有氧化性,只能作氧化剂(注:不一定是强氧化剂)。重要的氧化剂有: ①活泼非金属单质,如 X2(卤素单质)、O2、O3 等。②所含元素处于高价或较高价时的氧化物,如MnO2、NO2、PbO2 等。③所含元素处于高价时的含氧酸,如浓H2SO4、HNO3 等.④所含元素处于高价时的盐,如 KMnO4、KClO3、K2Cr2O7 等.⑤金属阳离子等,如 Fe3+、Cu 2+、Ag+、H+等.⑥过氧化物,如 Na2O2、H2O2 等.⑦特殊物质,如 HClO 也具有强氧化性. (2)所含元素的化合价处在最低价的物质只能失去电子,只具有还原性,只能作还原剂(注:不一定是强还原剂).重要的还原剂有: ①活泼金属单质,如 Na、K、Ca、Mg、Al、Fe 等.②某些非金属单质,如 C、H2、Si 等.③所含元素处于低价或较低价时的氧化物,如 CO、SO2 等.④所含元素处于低价或较低价时的化合物,如含有2S 、4S 、1I 、1Br 、2Fe 的化合物H2S、Na2S、H2SO3、Na2SO3、HI、HBr、FeSO4、NH3 等. (3)当所含元素处于中间价态时的物质,既有氧化性又有还原性,如 H2O2、SO2、Fe2+等. (4)当一种物质中既含有高价态元素又含有低价态元...