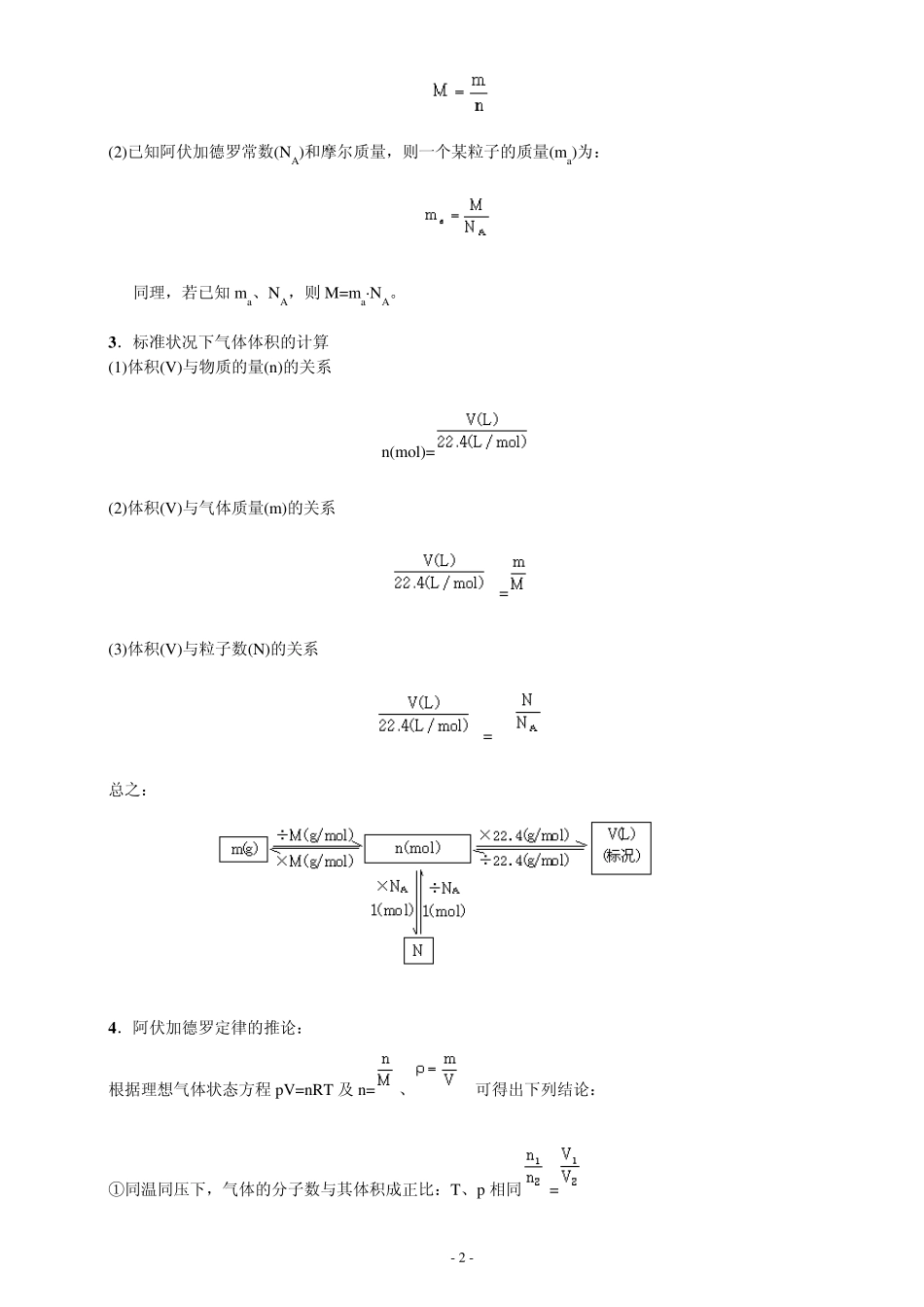
- 1 - 化学计算专题 ——物质的量、气体摩尔体积、燃烧及关于方程式的计算 [考点扫描] 1.有关物质的量的计算 2.有关气体摩尔体积的计算 3.利用化学方程式的计算 4.有关燃烧热的简单计算 [知识指津] 1.本章知识网络 2.摩尔质量的计算 (1)物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系为: - 2 - (2)已知阿伏加德罗常数(NA)和摩尔质量,则一个某粒子的质量(ma)为: 同理,若已知ma、NA,则M=ma·NA。 3.标准状况下气体体积的计算 (1)体积(V)与物质的量(n)的关系 n(mol)= (2)体积(V)与气体质量(m)的关系 = (3)体积(V)与粒子数(N)的关系 = 总之: 4.阿伏加德罗定律的推论: 根据理想气体状态方程pV=nRT 及n=、 可得出下列结论: ①同温同压下,气体的分子数与其体积成正比:T、p 相同= - 3 - ②温度、体积相同的气体,压强与其分子数成正比:T、V 相同= ③分子数相等,压强相同的气体,体积与其温度成正比:n、p相同= ④分子数相等,温度相同的气体,压强与其体积成反比:n、T 相同= ⑤同温同压下,气体的密度与其相对分子质量(实际是摩尔质量)成正比:T、p相同= ⑥同温同压下,体积相同的气体,相对分子质量与其质量成正比:T、P、V 相同= ⑦同温同压下,等质量的气体相对分子质量与其体积成反比:T、P、m 相同= 5.气体摩尔体积的计算 (标准状况下 Vm=22.4L/mol) 6.关于物质的量浓度的计算 (1)基本关系式的计算公式:cB=,cB 物质的量浓度,nB 溶质的物质的量,V 溶液的体积(L) (2)与溶液质量分数的换算:c= c 表示物质的量浓度,表示溶液的密度,W 表示溶液的质量分数,M 表示溶质的摩尔质量。 (3)溶液稀释(浓缩)的计算:c1V1=c2V2(稀释定律) 稀释前后溶质的物质的量不变,用于物质的量浓度溶液稀释。 (4)气体溶于水的物质的量浓度的计算: - 4 - 气体溶于水,所得溶液的体积跟水的体积不相同,溶液的体积也不等于气体的体积和水的体积的加和,必须依据溶液质量和密度来计算水溶液的体积(V=m/)。例如在标准状况下,1 体积水中溶解V 体积气体X,所得溶液的密度为,溶质的摩尔质量为M,计算c(X)。计算时可令1L 水中溶解VL 气体X。计算步骤为: 先求溶液的质量: m(液)=1000mL×1g/mL+×M 再求溶液的体积: V(液)= = ×10-3L/mL 最后求物质的量浓度: c(X)== [范例点击] [例1] NA 为阿伏加德罗常数,下列叙述正确的是( ) A.80g 硝酸铵...