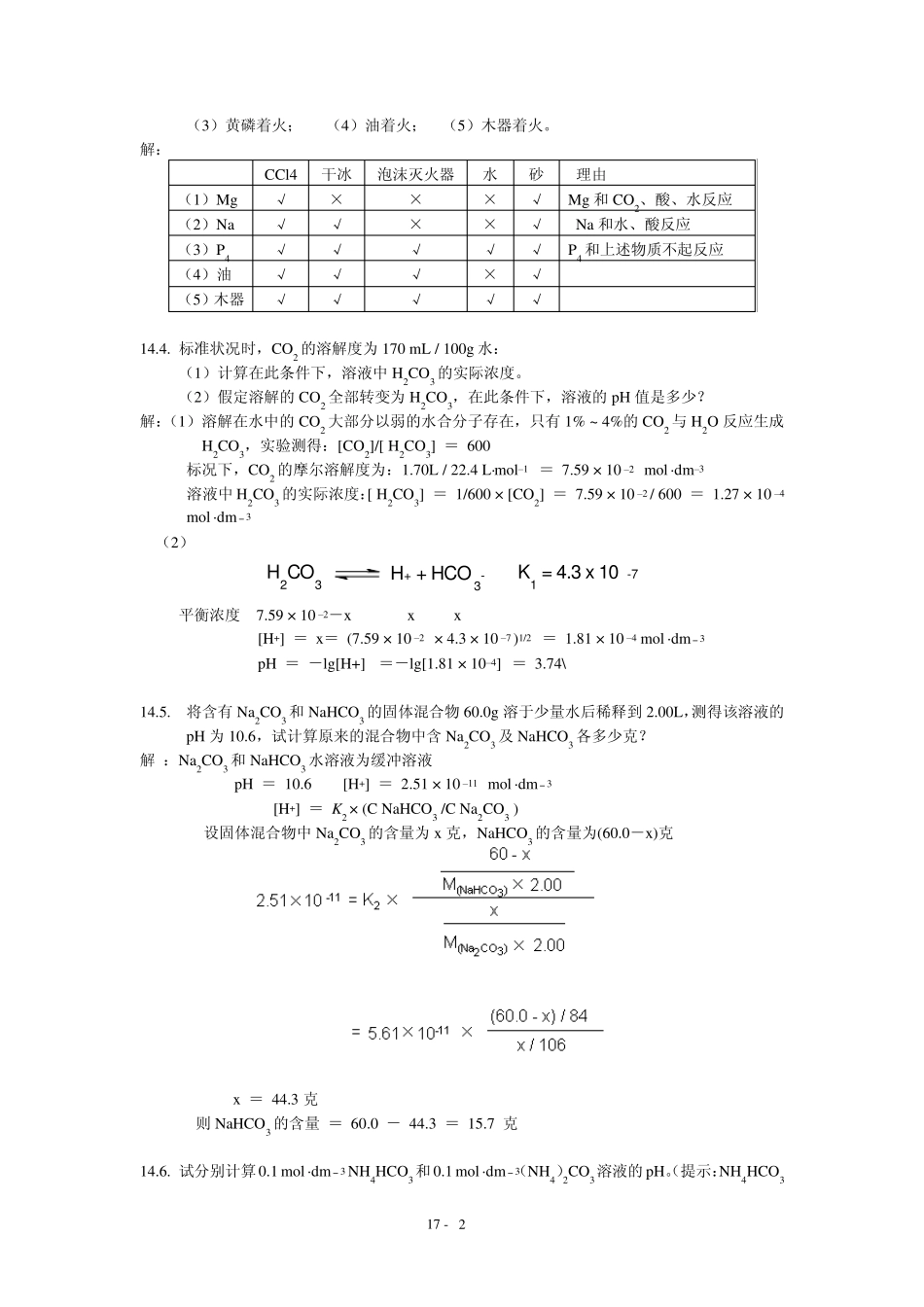
17 - 1 第1 4 章 碳、硅、硼 14.1. 对比等电子体CO 与N2 的分子结构及主要物理、化学性质。 解:CO 和N2 是等电子体(14e),分子轨道能级图相似,分子中都有三重键:∶N≡N∶、COδ +δ -∶ ∶ ,键能相近。一般条件下,两种物质都是气体,很少溶于水;熔、沸点,临界压力,临界温度等一些物理性质也相似。 但CO 和N2 分子中三重键特点并不完全相同,N2 分子中负电荷分布是对称的,而CO 却是不对称的。C 原子略带负电荷,再加上C 的电负性比N 小,因此CO 比N2 较易给出电子对向过渡金属原子(离子)配位,除形成σ ―配键外,还有π ―反馈键形成,故生成的配合物较稳定。而N2 的配位能力远不如 CO,分子氮配合物远不如羰基化合物稳定。所以 CO 的键能虽比N2 略大,但化学性质却比N2 要活泼,不象 N2 那样“惰性”。 14.2 概述CO的实验室制法及收集方法,写出CO与下列物质起反应的方程式并注明反应的条件:(1)Ni ;(2)Cu Cl ;(3)NaOH ;(4)H2 ;(5)PdCl2 解:CO 的实验室制法: HCOOH浓H2SO4 CO + H2O 用排水集气法收集。 (1) Ni + 4CO100 -250atm423 - 493KNi(CO)4 (2) (3) CO + NaOHHCOONa1.01× 103kPa473K (4) CO + 3H2 CH4 + H2OFe、Co、Ni523K,101kPa (5) CO + PdCl2 + H2O === Pd↓ + CO2 + 2HCl 14.3. 某实验室备有CCl4、干冰和泡沫灭火器(内为 Al2(SO4)3 和NaHCO3),还有水源和砂。若有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火; (2)金属钠着火; 17 - 2 (3)黄磷着火; (4)油着火; (5)木器着火。 解: CCl4 干冰 泡沫灭火器 水 砂 理由 (1)Mg √ × × × √ Mg 和 CO2、酸、水反应 (2)Na √ √ × × √ Na 和水、酸反应 (3)P4 √ √ √ √ √ P4 和上述物质不起反应 (4)油 √ √ √ × √ (5)木器 √ √ √ √ √ 14.4. 标准状况时,CO2 的溶解度为 170 mL / 100g 水: (1)计算在此条件下,溶液中 H2CO3 的实际浓度。 (2)假定溶解的 CO2 全部转变为 H2CO3,在此条件下,溶液的 pH 值是多少? 解:(1)溶解在水中的 CO2 大部分以弱的水合分子存在,只有 1% ~ 4%的 CO2 与 H2O 反应生成H2CO3,实验测得:[CO2]/[ H2CO3] = 600 标况下,CO2 的摩尔溶解度为:1.70L / 22.4 L...