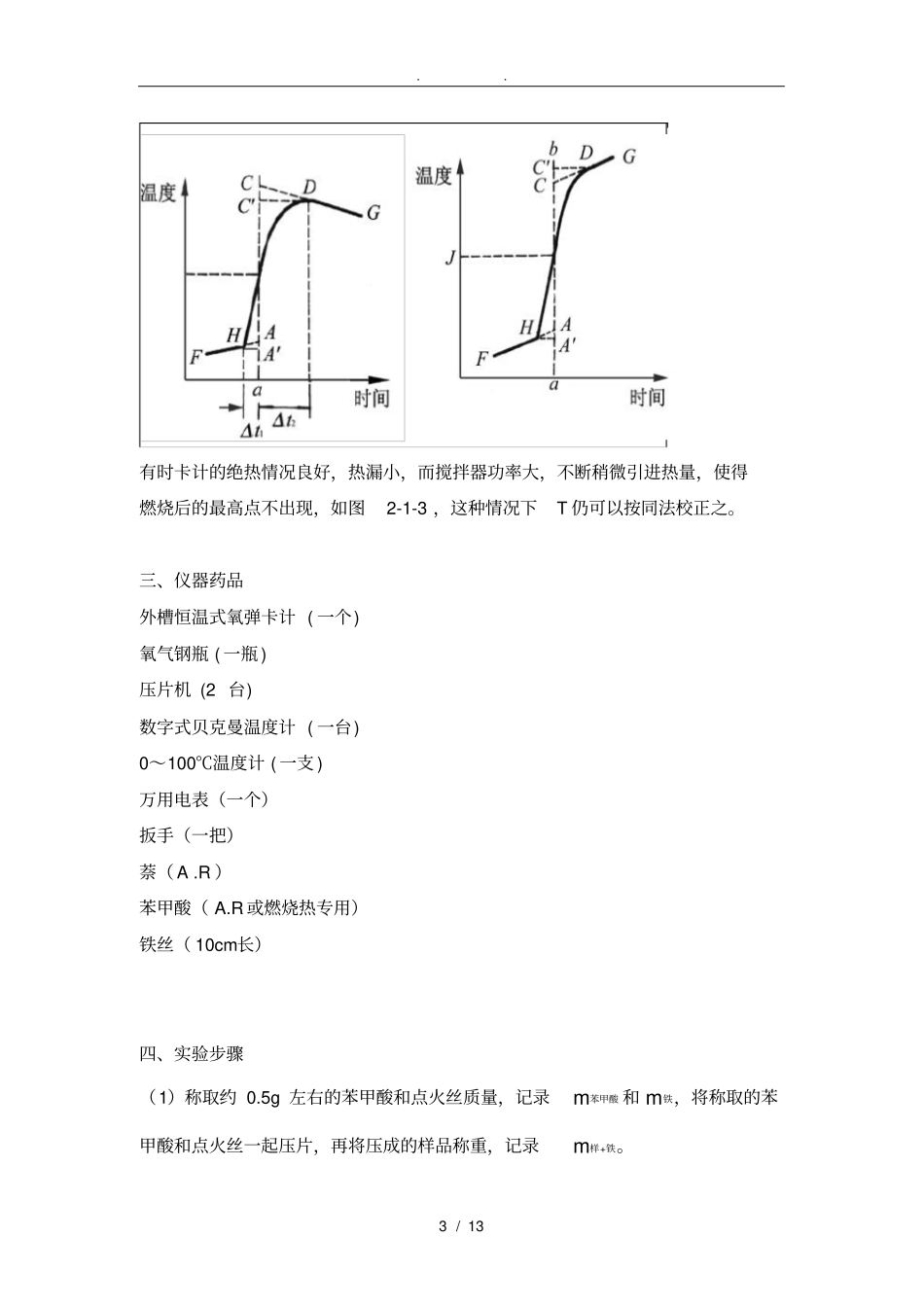
. . 1 / 13 燃烧热实验报告一、实验目的1、明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。2、掌握量热技术的基本原理,学会测定奈的燃烧热。3、了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。4、学会雷诺图解法校正温度改变值。二、实验原理燃烧热是指 1 摩尔物质完全燃烧时所放出的热量。 在恒容条件下测得的燃烧热称为恒容燃烧热( Qv,m),恒容燃烧热这个过程的能变化(ΔrUm)。在恒压条件下测得的燃烧热称为恒压燃烧热 (Qp,m),恒压燃烧热等于这个过程的热焓变化 (ΔrHm)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有以下关系式:cHm = Q p,m=Qv,m+Δ nRT (1)本实验采用氧弹式量热计测量萘的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧, 燃烧时放出的热量使卡计本身与氧弹周围介质(本实验用水)的温度升高。氧弹是一个特制的不锈钢容器。 为了保证化妆品在若完全燃烧, 氧弹中应充以高压氧气(或者其他氧化剂) ,还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高, 也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过雷诺矫正作图法进行校正。放出热 ( 样品+点火丝 ) =吸收热 ( 水、氧弹、量热计、温度计) 量热原理—能量守恒定律在盛有定水的容器中, 样品物质的量为 n 摩尔,放入密闭氧弹充氧, 使样品完全燃烧, 放出的热量传给水与仪器各部件,引起温度上升。 设系统(包括水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,即. . 2 / 13 量热计与水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为: 式中,Qv,m为样品的恒容摩尔燃烧热 (J · mol-1) ;n 为样品的摩尔数( mol) ;C为仪器的总热容 (J · K-1 或 J / ℃) 。上述公式是最理想、最简单的情况。但是,由于( 1):氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。 (2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火...