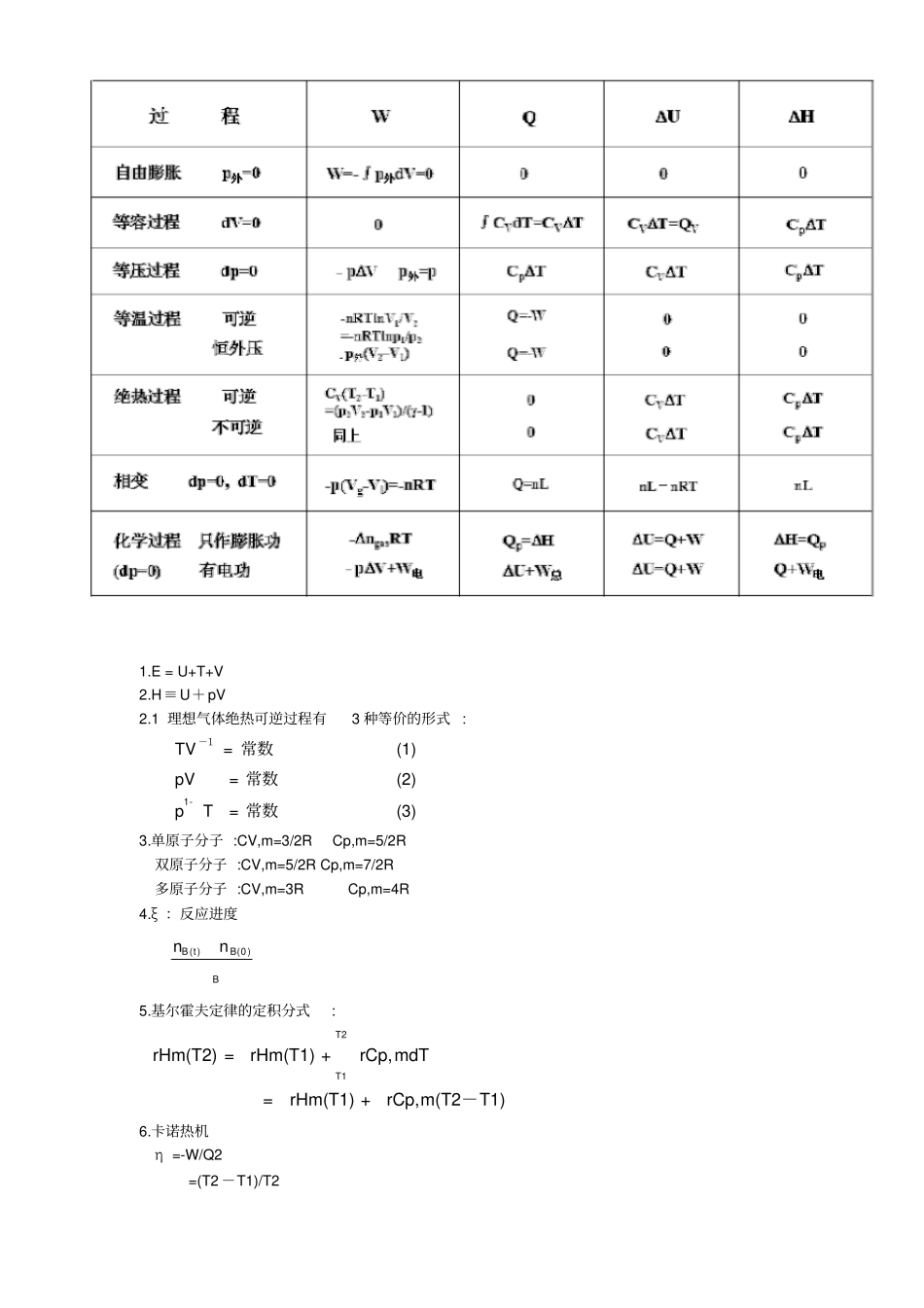
1.E = U+T+V 2.H≡U+pV 2.1 理想气体绝热可逆过程有3 种等价的形式 : (3)常数=Tp(2)常数=pV(1)常数=TV-1-13.单原子分子 :CV,m=3/2R Cp,m=5/2R 双原子分子 :CV,m=5/2R Cp,m=7/2R 多原子分子 :CV,m=3R Cp,m=4R 4.ξ :反应进度BBtBnn)0()(5.基尔霍夫定律的定积分式: T1)-m(T2rCp,+rHm(T1)=mdTrCp,+rHm(T1)=rHm(T2)T2T16.卡诺热机η =-W/Q2 =(T2 -T1)/T2 =1-(T1/T2) 7. 熵的微观意义:S=klnW W:宏观状态拥有的微观运动状态的数量k:Boltzmann 常数8.纯物质 B 在状态 (T,p) 的规定熵即为下述过程的熵变 : ),()0(pTBKBKpTBTKpTBSSSS0,0),(9. 等温过程的熵变: (理想气体 ) (p1/p2)nRln =Sp2/p1=V2/V1∴p2V2=p1V1 (1)(V2/V1)nRln =S1)/TnRTln(V2/V=-WR/T=QR/T=QR/T∫=S10. 绝热过程 : 绝热可逆过程 , 由熵的判别式 : 0=S绝热可逆(2) 绝热不可逆过程: 对此类过程需设计一条可逆途径, 从相同的始态到相同末态, 再沿可逆途径求算熵变 . 11. 变温过程 : 简单体系A. 等压变温 : )Cpln(T2/T1=(4)(Cp/T)dT=QR/T∫=SCpdT=QRB. 等容变温 : ln(T2/T1)C=/T)dT∫(C=/TQ∫=SdTC=QVVRVR12.相变过程:平衡相变:平衡相变是一可逆过程, 在等温等压下进行. /TQ=Q/T∫=SR平衡相变有 : H=Qp故平衡相变的熵变为: 相变H/T=S(6) 即:平衡相变的熵变等于相变潜热除以相变温度13.理想气体的混合过程: (1).A, B 先各自等温可逆膨胀到各自的末态; (2).可逆混合 . 第一步的熵变为: 2Rln2=)/VRln(V+)/VRln(V=S+S=S1B1,B2,A1,A2,BA第二步熵变为零14.赫氏自由能F≡U-TS 状态函数 ,广度性质 ,没有明确的物理意义,具有能量的量纲. 15.在等温过程中,一封闭系统所能作的最大功等于系统的亥姆霍兹函数的减少。16.Gibbs 自由能 (Gibbs free energy) G≡H-TS ( ≡F+pV 17.在一个封闭系统中进行的等温等压过程Gibss 函数值的减少等于系统对环境所作的最大非体积功 . 18.H=U+pV F=U-TS G=H -TS =F+pV 19. dU=TdS - pdV (1) dH=TdS+Vdp (2) dF= -SdT -pdV (3) dG=-SdT+Vdp (4) 20. G的计算( 1)等温过程的G: Vdp∫=G1〉理想气体等温过程: 2)nRTln(V1/V=1)nRTln(p2/p=G∫dlnpnRT=nRT/pdp∫=G2〉 2. 凝聚体系等温过程的G: G=∫Vdp 因凝聚体系的V 可视为常量 ,故: G=V(p2 - p1) 对于实际气体 , 或需考虑体积变化的凝聚相, 则可将物质的状态方程代入(...