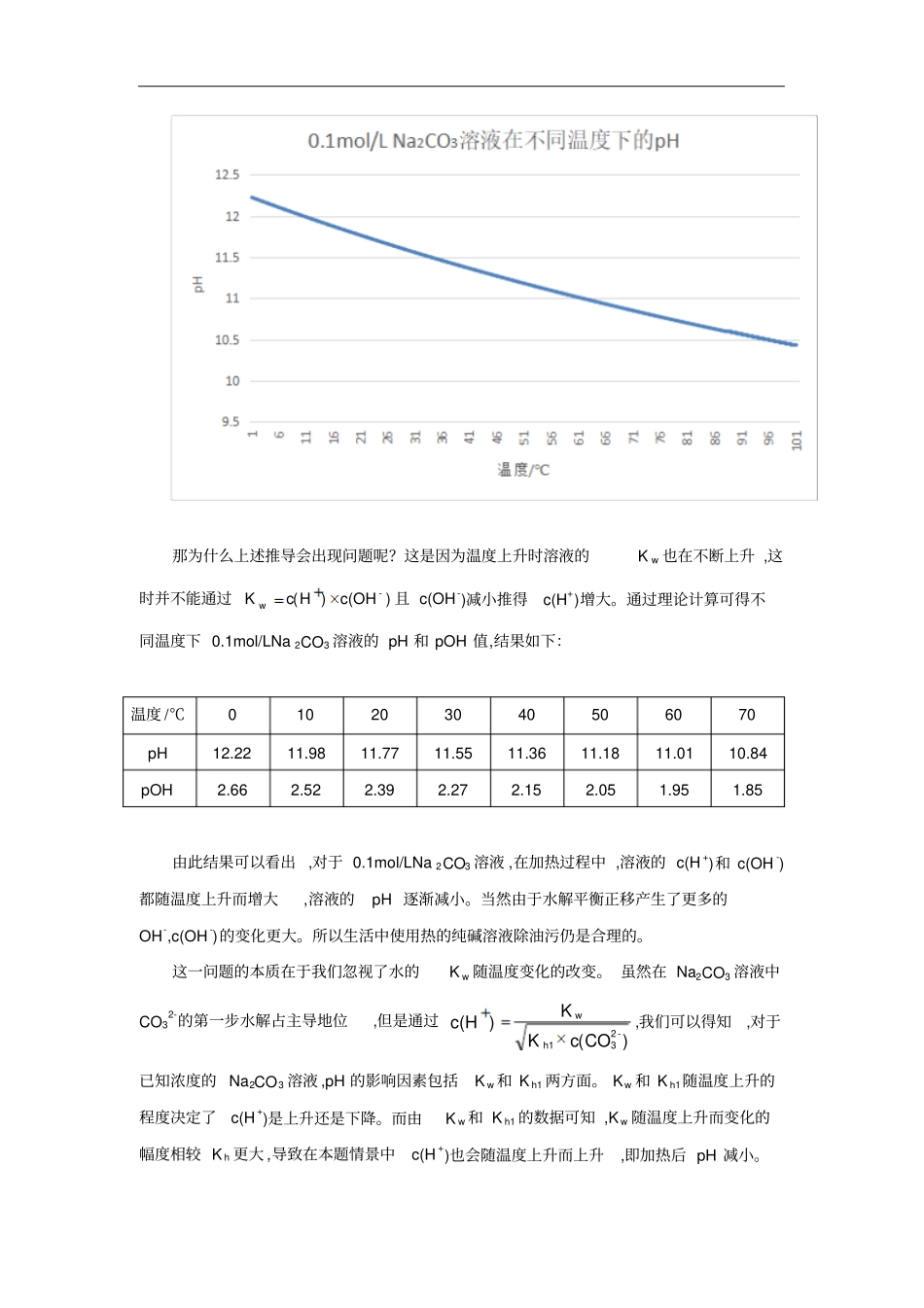
(2014?江苏 )下列有关说法正确的是(C) A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀B.2NO(g) +2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△ H>0 C.加热 0.1mol?L﹣ 1 Na2CO3 溶液 ,CO32﹣的水解程度和溶液的pH 均增大D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大解答: C.碳酸钠溶液中碳酸根发生水解,溶液呈碱性 ,而盐类水解是吸热反应,升高温度 ,水解程度增大 ,溶液碱性增强 ,即溶液的 pH 均增大 ,故 C 正确。这道 14 年江苏高考题的C 选项旨在考察加热对水解反应的影响。几乎所有参考资料对于该选项的解释都是:饱和Na2CO3 溶液中存在CO32-的水解平衡CO32-+H 2O ? HCO 3-+OH- ,该反应 △H>0,为吸热反应。加热使溶液温度上升,有利于该水解平衡向正反应方向移动 ,即使水解程度增大。进而导致c(OH-)增大 ,c(H+)下降 ,溶液的 pH 上升。但在查阅资料后我们发现,通过手持传感器测量0.1mol/LNa 2CO3 溶液的实验表明 ,在加热过程中Na2CO3 溶液的 pH 实际上是不断下降的,结果如下图所示。这并不符合我们的一般认知,为验证该说法是否准确,我们尝试对0.1mol/LNa 2CO3溶液在不同温度下的pH 进行计算。但由于碳酸根的K h 和水的电离常数K w 随温度的变化没有确切数据 ,我们进一步查找了Na2CO3 溶液中各组成成分的热力学函数值,并根据范特霍夫方程计算出了0-100℃范围内不同温度下碳酸根的K h1 和 K h2和 K w。其中部分数据如下表:温度 /℃K h1K h2K w0 4.75×10-54.27×10-91.30×10-1510 9.01×10-58.74×10-93.09×10-1520 1.64×10-41.70×10-86.95×10-1530 2.85×10-43.18×10-81.48×10-1440 4.80×10-45.70×10-83.00×10-1450 7.83×10-49.86×10-85.82×10-1460 1.24×10-31.65×10-71.09×10-1370 1.91×10-32.68×10-71.95×10-1380 2.87×10-34.24×10-73.40×10-1390 4.23×10-36.53×10-75.74×10-13100 6.09×10-39.83×10-79.42×10-13由此可以看出 ,K h1>>K h2>>K w,碳酸根的第一步水解的程度远远大于第二步水解和水的电离 ,故在分析 Na2CO3 溶液时 ,对于 CO32-+H 2O ? HCO3-+OH- ,我们可以忽略第二步水解和水电离对氢氧根浓度的影响,近似认为 c(OH-)≈c(HCO 3-)。该反应)CO(c)OH(c)CO(c)OH(c)HCO(cK-23-2-23--31h,故)CO(cK)OH(c-23h1-。又有)OH(c)H(cK-w, 将 c(OH-)代入得...