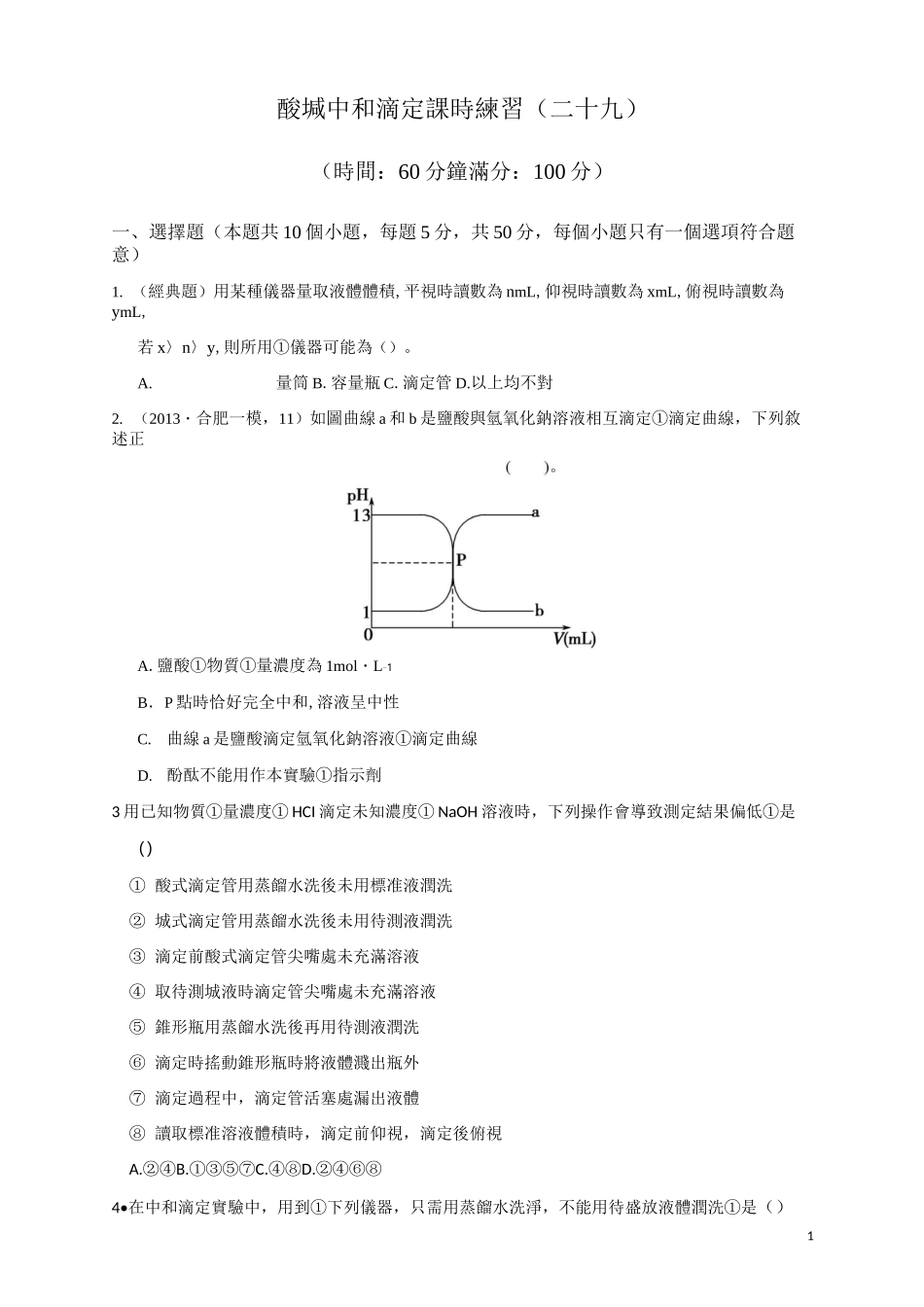
1酸堿中和滴定課時練習(二十九)(時間:60 分鐘滿分:100 分)一、選擇題(本題共 10 個小題,每題 5 分,共 50 分,每個小題只有一個選項符合題意)1. (經典題)用某種儀器量取液體體積,平視時讀數為 nmL,仰視時讀數為 xmL,俯視時讀數為ymL,若 x〉n〉y,則所用①儀器可能為()。A.量筒 B.容量瓶 C.滴定管 D.以上均不對2. (2013・合肥一模,11)如圖曲線 a 和 b 是鹽酸與氫氧化鈉溶液相互滴定①滴定曲線,下列敘述正A.鹽酸①物質①量濃度為 1mol・L-1B.P 點時恰好完全中和,溶液呈中性C.曲線 a 是鹽酸滴定氫氧化鈉溶液①滴定曲線D.酚酞不能用作本實驗①指示劑3 用已知物質①量濃度① HCI 滴定未知濃度① NaOH 溶液時,下列操作會導致測定結果偏低①是()① 酸式滴定管用蒸餾水洗後未用標准液潤洗② 城式滴定管用蒸餾水洗後未用待測液潤洗③ 滴定前酸式滴定管尖嘴處未充滿溶液④ 取待測城液時滴定管尖嘴處未充滿溶液⑤ 錐形瓶用蒸餾水洗後再用待測液潤洗⑥ 滴定時搖動錐形瓶時將液體濺出瓶外⑦ 滴定過程中,滴定管活塞處漏出液體⑧ 讀取標准溶液體積時,滴定前仰視,滴定後俯視A.②④B.①③⑤⑦C.④⑧D.②④⑥⑧4•在中和滴定實驗中,用到①下列儀器,只需用蒸餾水洗淨,不能用待盛放液體潤洗①是()A.酸式滴定2B.城式滴定C.移液D・錐形5. 某稀 NaOH 溶液①濃度大約在 0.07mol•L-i~0.08mol•L-i之間,實驗室現有① 0.1mol•L-i,②1.0mol・L-1,③5.0mol・L-1① 三種標准鹽酸,若要通過中和滴定法確定氫氧化鈉①准確濃度,則應選用①標准鹽酸溶液是A.①B.②C.③D.①②③ 均可6.用標准 NaOH 溶液滴定待測鹽酸①下列操作中,會使測定結果偏高①是()A. 城式滴定管用蒸餾水洗淨後,未經標准液潤洗就注入標准 NaOH 溶液B.用酸式滴定管取待測液前,尖嘴部分有氣泡,使用過程中變無C.錐形瓶中有少量蒸餾水D. 滴定前,讀城液體積時,視線低於城式滴定管中①液面(仰視)7. 將 10mL0.2mol•L-1鹽酸和 10mL0.10mol•L-1Ba(OH)2混合,再用水稀釋至 5L,取出 10mL 滴入甲基橙試劑,溶液顯示①顏色是()A.藍色 B.紅色 C.黃色 D.橙色8. 現用 0.10mol•L-1鹽酸滴定 10mL0.05mol•L-1NaOH,若酸式滴定管未潤洗,達到終點時所用鹽酸①體積應是()A.10mLB.5mLC.大於 5mLD.小於 5mL9•用已知濃度①鹽酸滴定未知濃度①氫氧化鈉溶液時,下列實驗操作:①用天平稱量 NaOH 固體,將小燒杯放...